เนื้อหาเชิงทฤษฎี คุณสามารถขอคำแนะนำจากผู้เชี่ยวชาญได้ในที่สุด
กรุณาส่งต้นฉบับนี้ให้กับบรรณาธิการ - คำนำ (“ ฉันถามคุณ”); ช่วยบอกฉันทีว่าเขากล้าแค่ไหน! - ทั้งหมด...
ค่าคงที่ของโบลทซ์มันน์ (k (\displaystyle k)หรือ k B (\displaystyle k_(\rm (B)))) - ค่าคงที่ทางกายภาพที่กำหนดความสัมพันธ์ระหว่างอุณหภูมิและพลังงาน ตั้งชื่อตามนักฟิสิกส์ชาวออสเตรีย ลุดวิก โบลต์ซมันน์ ซึ่งมีส่วนสำคัญในวิชาฟิสิกส์เชิงสถิติ โดยค่าคงที่นี้มีบทบาทสำคัญ มูลค่าในระบบสากลของหน่วย SI ตามการเปลี่ยนแปลงคำจำกัดความของหน่วย SI พื้นฐานจะเท่ากับทุกประการ
k = 1.380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\times 10^(-23))เจ/.ในก๊าซอุดมคติที่เป็นเนื้อเดียวกันที่อุณหภูมิสัมบูรณ์ T (\displaystyle T)พลังงานต่อระดับความเป็นอิสระในการแปลแต่ละระดับจะเท่ากัน ดังนี้จากการกระจายตัวของแมกซ์เวลล์ k T / 2 (\displaystyle kT/2)- ที่อุณหภูมิห้อง (300 ) พลังงานนี้คือ 2 , 07 × 10 − 21 (\รูปแบบการแสดงผล 2(,)07\คูณ 10^(-21))เจ หรือ 0.013 eV ในก๊าซอุดมคติเชิงเดี่ยว แต่ละอะตอมมีระดับความเป็นอิสระสามระดับซึ่งสอดคล้องกับแกนเชิงพื้นที่สามแกน ซึ่งหมายความว่าแต่ละอะตอมมีพลังงาน 3 2 k T (\displaystyle (\frac (3)(2))kT).
เมื่อทราบพลังงานความร้อนแล้ว เราสามารถคำนวณความเร็วเฉลี่ยกำลังสองของรากของอะตอมได้ ซึ่งเป็นสัดส่วนผกผันกับรากที่สองของมวลอะตอม ความเร็วกำลังสองเฉลี่ยรากที่อุณหภูมิห้องแปรผันจาก 1370 m/s สำหรับฮีเลียม ถึง 240 m/s สำหรับซีนอน ในกรณีของโมเลกุลก๊าซสถานการณ์จะซับซ้อนมากขึ้นเช่นก๊าซไดอะตอมมิกมีอิสระ 5 องศา - การแปล 3 แบบและการหมุน 2 แบบ (ที่อุณหภูมิต่ำเมื่อการสั่นสะเทือนของอะตอมในโมเลกุลไม่ตื่นเต้นและมีระดับเพิ่มเติมของ ไม่เพิ่มเสรีภาพ)
เอนโทรปีของระบบอุณหพลศาสตร์ถูกกำหนดให้เป็นลอการิทึมธรรมชาติของจำนวนไมโครสเตตต่างๆ Z (\displaystyle Z)ซึ่งสอดคล้องกับสถานะมหภาคที่กำหนด (เช่น สถานะที่มีพลังงานทั้งหมดที่กำหนด)
S = k ln Z . (\displaystyle S=k\ln Z)ปัจจัยสัดส่วน k (\displaystyle k)และเป็นค่าคงที่ของ Boltzmann นี่คือการแสดงออกที่กำหนดความสัมพันธ์ระหว่างกล้องจุลทรรศน์ ( Z (\displaystyle Z)) และสถานะมหภาค ( เอส (\displaystyle S)) เป็นการแสดงออกถึงแนวคิดหลักของกลศาสตร์ทางสถิติ
ตามกฎของสเตฟาน-โบลต์ซมันน์ ความหนาแน่นของรังสีในซีกโลกหนึ่ง อี 0ขึ้นอยู่กับอุณหภูมิเท่านั้นและแปรผันตามสัดส่วนกำลังสี่ของอุณหภูมิสัมบูรณ์ ต:
ค่าคงที่สเตฟาน–โบลต์ซมันน์ σ 0 เป็นค่าคงที่ทางกายภาพที่รวมอยู่ในกฎหมายที่กำหนดความหนาแน่นเชิงปริมาตรของการแผ่รังสีความร้อนที่สมดุลของวัตถุสีดำสนิท:

ในอดีต กฎสเตฟาน-โบลต์ซมันน์ถูกกำหนดขึ้นก่อนกฎรังสีของพลังค์ ซึ่งตามมาด้วยผลที่ตามมา กฎของพลังค์กำหนดความขึ้นต่อกันของความหนาแน่นฟลักซ์สเปกตรัมของรังสี อี 0 เรื่องความยาวคลื่น แลมบ์ และอุณหภูมิ ต:

โดยที่ λ – ความยาวคลื่น, m; กับ=2.998 10 8 m/s – ความเร็วแสงในสุญญากาศ; ต– อุณหภูมิร่างกาย K;
ชม.= 6.625 ×10 -34 J×s – ค่าคงที่ของพลังค์
ค่าคงที่ทางกายภาพ เคเท่ากับอัตราส่วนของค่าคงที่ก๊าซสากล ร=8314J/(kg×K) เท่ากับเลขอาโวกาโดร เอ็น.เอ.=6.022× 10 26 1/(กก.×โมล):

จำนวนการกำหนดค่าระบบที่แตกต่างกัน เอ็นอนุภาคสำหรับชุดตัวเลขที่กำหนด ฉัน(จำนวนอนุภาคใน ฉัน- สถานะที่พลังงาน e i สอดคล้องกัน) เป็นสัดส่วนกับค่า:

ขนาด วมีหลายวิธีในการกระจาย เอ็นอนุภาคตามระดับพลังงาน หากความสัมพันธ์ (6) เป็นจริง จะถือว่าระบบเดิมเป็นไปตามสถิติของ Boltzmann ชุดตัวเลข ฉันซึ่งจำนวนนั้น วสูงสุด เกิดขึ้นบ่อยที่สุดและสอดคล้องกับการแจกแจงที่เป็นไปได้มากที่สุด
จลนศาสตร์ทางกายภาพ– ทฤษฎีจุลทรรศน์ของกระบวนการในระบบที่ไม่มีความสมดุลทางสถิติ
การอธิบายอนุภาคจำนวนมากสามารถทำได้สำเร็จโดยใช้วิธีความน่าจะเป็น สำหรับก๊าซ monatomic สถานะของชุดโมเลกุลจะถูกกำหนดโดยพิกัดและค่าของการประมาณการความเร็วบนแกนพิกัดที่สอดคล้องกัน ในทางคณิตศาสตร์ สิ่งนี้อธิบายได้ด้วยฟังก์ชันการแจกแจง ซึ่งระบุลักษณะความน่าจะเป็นที่อนุภาคจะอยู่ในสถานะที่กำหนด:

คือจำนวนโมเลกุลที่คาดหวังในปริมาตร d d ซึ่งมีพิกัดอยู่ในช่วงตั้งแต่ถึง +d และมีความเร็วอยู่ในช่วงตั้งแต่ถึง +d
หากสามารถละเลยพลังงานศักย์เฉลี่ยตามเวลาของปฏิสัมพันธ์ของโมเลกุลเมื่อเปรียบเทียบกับพลังงานจลน์ของพวกมัน ก๊าซนั้นจะถูกเรียกว่าอุดมคติ ก๊าซในอุดมคติเรียกว่าก๊าซโบลต์ซมันน์ หากอัตราส่วนของความยาวเส้นทางของโมเลกุลในก๊าซนี้ต่อขนาดลักษณะเฉพาะของการไหล ลแน่นอน กล่าวคือ

เพราะ ความยาวเส้นทางเป็นสัดส่วนผกผัน อันดับ 2(n คือความหนาแน่นเชิงตัวเลข 1/m 3, d คือเส้นผ่านศูนย์กลางของโมเลกุล, m)
ขนาด
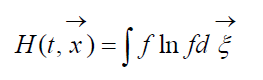
เรียกว่า ชม-ฟังก์ชัน Boltzmann สำหรับหน่วยปริมาตร ซึ่งสัมพันธ์กับความน่าจะเป็นในการตรวจจับระบบโมเลกุลของก๊าซในสถานะที่กำหนด แต่ละสถานะสอดคล้องกับจำนวนเซลล์ความเร็วอวกาศหกมิติที่เติมเข้าไป ซึ่งสามารถแบ่งช่องว่างเฟสของโมเลกุลที่อยู่ระหว่างการพิจารณาได้ มาแสดงกันเถอะ วความน่าจะเป็นที่จะมีโมเลกุล N 1 ในเซลล์แรกของช่องว่างที่พิจารณา, N 2 ในเซลล์ที่สอง เป็นต้น
จนถึงค่าคงที่ที่กำหนดที่มาของความน่าจะเป็น ความสัมพันธ์ต่อไปนี้ใช้ได้:
 ,
,
ที่ไหน  – ฟังก์ชัน H ของขอบเขตพื้นที่ กครอบครองโดยก๊าซ จาก (9) ชัดเจนว่า วและ ชมเชื่อมต่อกันเช่น การเปลี่ยนแปลงความน่าจะเป็นของสถานะจะนำไปสู่การวิวัฒนาการที่สอดคล้องกันของฟังก์ชัน H
– ฟังก์ชัน H ของขอบเขตพื้นที่ กครอบครองโดยก๊าซ จาก (9) ชัดเจนว่า วและ ชมเชื่อมต่อกันเช่น การเปลี่ยนแปลงความน่าจะเป็นของสถานะจะนำไปสู่การวิวัฒนาการที่สอดคล้องกันของฟังก์ชัน H

หลักการของ Boltzmann สร้างความเชื่อมโยงระหว่างเอนโทรปี สระบบทางกายภาพและความน่าจะเป็นทางอุณหพลศาสตร์ วรัฐของเธอ:

(เผยแพร่ตามสิ่งพิมพ์: Kogan M.N. พลศาสตร์ของก๊าซทำให้บริสุทธิ์ - M.: Nauka, 1967.)
มุมมองทั่วไปของ CUBE:

แรงมวลอยู่ที่ไหนเนื่องจากการมีอยู่ของสนามต่าง ๆ (แรงโน้มถ่วง, ไฟฟ้า, แม่เหล็ก) ที่กระทำต่อโมเลกุล เจ– อินทิกรัลการชนกัน มันเป็นเทอมของสมการ Boltzmann นี้ที่คำนึงถึงการชนกันของโมเลกุลซึ่งกันและกันและการเปลี่ยนแปลงความเร็วของอนุภาคที่มีปฏิสัมพันธ์กัน อินทิกรัลการชนกันเป็นอินทิกรัลห้ามิติและมีโครงสร้างดังนี้

ได้รับสมการ (12) กับอินทิกรัล (13) สำหรับการชนของโมเลกุลที่ไม่มีแรงสัมผัสเกิดขึ้นเช่น อนุภาคที่ชนกันถือว่ามีความเรียบอย่างสมบูรณ์แบบ
ในระหว่างการโต้ตอบพลังงานภายในของโมเลกุลจะไม่เปลี่ยนแปลงเช่น โมเลกุลเหล่านี้ถือว่ายืดหยุ่นได้อย่างสมบูรณ์แบบ เราพิจารณาโมเลกุลสองกลุ่มที่มีความเร็วและก่อนที่จะชนกัน (การชนกัน) (รูปที่ 1) และหลังจากการชนตามลำดับความเร็ว และ . ความแตกต่างของความเร็วเรียกว่าความเร็วสัมพัทธ์เช่น - เห็นได้ชัดว่าเพื่อการชนแบบยืดหยุ่นที่ราบรื่น ฟังก์ชันการกระจาย ฉ 1 ", ฉ", ฉ 1 , ฉอธิบายโมเลกุลของกลุ่มที่เกี่ยวข้องหลังและก่อนการชนเช่น - ![]() ;
; ![]() ;
; ![]() .
.

ข้าว. 1. การชนกันของโมเลกุลทั้งสอง
(13) รวมถึงพารามิเตอร์สองตัวที่แสดงคุณลักษณะตำแหน่งของโมเลกุลที่ชนกันซึ่งสัมพันธ์กัน: ขและ ε; ข– ระยะการเล็ง เช่น ระยะทางที่เล็กที่สุดที่โมเลกุลจะเข้าใกล้ในกรณีที่ไม่มีปฏิสัมพันธ์ (รูปที่ 2) ε เรียกว่าพารามิเตอร์เชิงมุมการชนกัน (รูปที่ 3) บูรณาการมากกว่า ขจาก 0 ถึง ¥ และจาก 0 ถึง 2p (อินทิกรัลภายนอกสองตัวใน (12)) ครอบคลุมระนาบปฏิสัมพันธ์ของแรงทั้งหมดที่ตั้งฉากกับเวกเตอร์

ข้าว. 2. วิถีโคจรของโมเลกุล

ข้าว. 3. การพิจารณาปฏิสัมพันธ์ของโมเลกุลในระบบพิกัดทรงกระบอก: z, ข, ε
สมการจลนศาสตร์ของ Boltzmann ได้มาจากสมมติฐานและสมมติฐานต่อไปนี้
1. เชื่อกันว่าการชนกันของโมเลกุลทั้งสองส่วนใหญ่เกิดขึ้น กล่าวคือ บทบาทของการชนกันของโมเลกุลสามโมเลกุลขึ้นไปพร้อมกันนั้นไม่มีนัยสำคัญ สมมติฐานนี้ช่วยให้เราสามารถใช้ฟังก์ชันการกระจายอนุภาคเดี่ยวสำหรับการวิเคราะห์ ซึ่งข้างต้นเรียกง่ายๆ ว่าฟังก์ชันการกระจาย เมื่อคำนึงถึงการชนกันของโมเลกุลทั้งสามทำให้จำเป็นต้องใช้ฟังก์ชันการกระจายอนุภาคแบบสองอนุภาคในการศึกษานี้ ดังนั้นการวิเคราะห์จึงมีความซับซ้อนมากขึ้นอย่างมาก
2. การสันนิษฐานของความสับสนวุ่นวายระดับโมเลกุล แสดงให้เห็นข้อเท็จจริงที่ว่าความน่าจะเป็นในการตรวจจับอนุภาค 1 ที่จุดเฟสและอนุภาค 2 ที่จุดเฟสนั้นเป็นอิสระจากกัน
3. การชนกันของโมเลกุลที่มีระยะการกระแทกมีความเป็นไปได้เท่ากัน กล่าวคือ ฟังก์ชันการกระจายไม่เปลี่ยนแปลงที่เส้นผ่านศูนย์กลางปฏิสัมพันธ์ ควรสังเกตว่าองค์ประกอบที่วิเคราะห์จะต้องมีขนาดเล็กเช่นนั้น ฉภายในองค์ประกอบนี้ไม่เปลี่ยนแปลง แต่ในขณะเดียวกันเพื่อให้ความผันผวนของสัมพัทธ์ ~ ไม่มาก ศักยภาพในการโต้ตอบที่ใช้ในการคำนวณอินทิกรัลการชนนั้นมีความสมมาตรแบบทรงกลม เช่น ![]() .
.
สถานะสมดุลของก๊าซอธิบายโดยการแจกแจงแบบแมกซ์เวลเลียนสัมบูรณ์ ซึ่งเป็นคำตอบที่แน่นอนของสมการจลน์ของโบลต์ซมันน์:

โดยที่ m คือมวลของโมเลกุล กิโลกรัม
การแจกแจงแบบแมกซ์เวลเลียนในท้องถิ่นทั่วไป หรือเรียกอีกอย่างว่าการแจกแจงแบบแมกซ์เวลล์-โบลต์ซมันน์:

ในกรณีที่ก๊าซเคลื่อนที่โดยรวมด้วยความเร็วและตัวแปร n, T ขึ้นอยู่กับพิกัด
และเวลา t
ในสนามโน้มถ่วงของโลก ผลเฉลยที่แน่นอนของสมการโบลต์ซมันน์แสดงดังนี้:
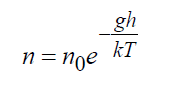
ที่ไหน n 0 = ความหนาแน่นที่พื้นผิวโลก 1/ลบ.ม. ก– ความเร่งด้วยแรงโน้มถ่วง, m/s 2 ; ชม.– ความสูง m สูตร (16) เป็นคำตอบที่แน่นอนของสมการจลน์ของ Boltzmann ไม่ว่าจะในอวกาศไม่จำกัดหรือในขอบเขตที่ไม่ละเมิดการกระจายตัวนี้ ในขณะที่อุณหภูมิก็ต้องคงที่เช่นกัน
หน้านี้ออกแบบโดย Puzina Yu.Yu ด้วยการสนับสนุนของมูลนิธิรัสเซียเพื่อการวิจัยขั้นพื้นฐาน - โครงการหมายเลข 08-08-00638
สำหรับค่าคงที่ที่เกี่ยวข้องกับพลังงานของการแผ่รังสีวัตถุดำ ดูค่าคงที่สเตฟาน-โบลต์ซมันน์
|
ค่าคงที่ เค |
มิติ |
|
1,380 6504(24) 10 −23 |
|
|
8,617 343(15) 10 −5 |
|
|
1,3807 10 −16 |
|
|
ดูเพิ่มเติมค่าในหน่วยต่างๆด้านล่าง |
|
ค่าคงที่ของ Boltzmann (เคหรือ เค B) เป็นค่าคงที่ทางกายภาพที่กำหนดความสัมพันธ์ระหว่างอุณหภูมิของสารกับพลังงานของการเคลื่อนที่ด้วยความร้อนของอนุภาคของสารนี้ ตั้งชื่อตามนักฟิสิกส์ชาวออสเตรีย ลุดวิก โบลต์ซมันน์ ซึ่งมีส่วนสำคัญในวิชาฟิสิกส์เชิงสถิติ โดยค่าคงที่นี้มีบทบาทสำคัญ ค่าทดลองในระบบ SI คือ
ในตาราง ตัวเลขสุดท้ายในวงเล็บแสดงถึงข้อผิดพลาดมาตรฐานของค่าคงที่ โดยหลักการแล้ว ค่าคงที่ของโบลต์ซมันน์สามารถหาได้จากคำนิยามของอุณหภูมิสัมบูรณ์และค่าคงที่ทางกายภาพอื่นๆ อย่างไรก็ตาม การคำนวณค่าคงที่ของ Boltzmann อย่างแม่นยำโดยใช้หลักการแรกนั้นซับซ้อนเกินไปและเป็นไปไม่ได้กับสถานะความรู้ในปัจจุบัน
ค่าคงที่ของโบลต์ซมันน์สามารถหาได้จากการทดลองโดยใช้กฎการแผ่รังสีความร้อนของพลังค์ ซึ่งอธิบายการกระจายพลังงานในสเปกตรัมของการแผ่รังสีสมดุลที่อุณหภูมิที่กำหนดของร่างกายที่เปล่งแสง เช่นเดียวกับวิธีการอื่นๆ
มีความสัมพันธ์ระหว่างค่าคงที่ก๊าซสากลกับเลขอาโวกาโดร ซึ่งค่าของค่าคงที่ของโบลต์ซมันน์จะเป็นดังนี้:
มิติของค่าคงที่ของ Boltzmann นั้นเหมือนกับของเอนโทรปี
|
ในปี พ.ศ. 2420 โบลต์ซมันน์เป็นคนแรกที่เชื่อมโยงเอนโทรปีและความน่าจะเป็น แต่เป็นค่าคงที่ที่ค่อนข้างแม่นยำ เคเนื่องจากค่าสัมประสิทธิ์การมีเพศสัมพันธ์ในสูตรเอนโทรปีปรากฏเฉพาะในงานของ M. Planck เมื่อได้รับกฎการแผ่รังสีวัตถุดำ พลังค์ในปี พ.ศ. 2443-2444 สำหรับค่าคงที่โบลต์ซมันน์ เขาพบค่า 1.346 10 −23 J/K ซึ่งน้อยกว่าค่าที่ยอมรับในปัจจุบันเกือบ 2.5%
ก่อนปี 1900 ความสัมพันธ์ที่ปัจจุบันเขียนด้วยค่าคงที่โบลต์ซมันน์ถูกเขียนโดยใช้ค่าคงที่ของแก๊ส รและแทนที่จะใช้พลังงานเฉลี่ยต่อโมเลกุล พลังงานทั้งหมดของสารก็ถูกนำมาใช้ สูตรพูดน้อยของแบบฟอร์ม ส = เคบันทึก วบนรูปปั้นครึ่งตัวของ Boltzmann ต้องขอบคุณพลังค์อย่างมาก ในการบรรยายโนเบลของเขาในปี 1920 พลังค์เขียนว่า:
ค่าคงที่นี้มักเรียกว่าค่าคงที่ของ Boltzmann แม้ว่าเท่าที่ฉันรู้ Boltzmann เองก็ไม่เคยแนะนำมันมาก่อนซึ่งเป็นสถานการณ์ที่แปลกแม้ว่าคำกล่าวของ Boltzmann จะไม่ได้พูดถึงการวัดที่แน่นอนของค่าคงที่นี้ก็ตาม
สถานการณ์นี้สามารถอธิบายได้ด้วยการอภิปรายทางวิทยาศาสตร์ที่กำลังดำเนินอยู่ในขณะนั้นเพื่อชี้แจงสาระสำคัญของโครงสร้างอะตอมของสสาร ในช่วงครึ่งหลังของศตวรรษที่ 19 มีความขัดแย้งกันอย่างมากว่าอะตอมและโมเลกุลมีจริงหรือเป็นเพียงวิธีที่สะดวกในการอธิบายปรากฏการณ์ นอกจากนี้ยังไม่มีความเห็นเป็นเอกฉันท์ว่า "โมเลกุลเคมี" จำแนกตามมวลอะตอมของพวกมันนั้นเป็นโมเลกุลเดียวกันกับในทฤษฎีจลน์ศาสตร์หรือไม่ นอกจากนี้ในการบรรยายโนเบลของพลังค์ยังมีสิ่งต่อไปนี้:
“ไม่มีสิ่งใดสามารถแสดงให้เห็นถึงอัตราความก้าวหน้าเชิงบวกและเร่งความเร็วได้ดีไปกว่าศิลปะการทดลองในช่วงยี่สิบปีที่ผ่านมา เมื่อมีการค้นพบวิธีการมากมายในการวัดมวลของโมเลกุลในคราวเดียวด้วยความแม่นยำเกือบเท่ากับการวัดมวลของดาวเคราะห์ ”
สำหรับก๊าซอุดมคติ กฎก๊าซรวมที่เกี่ยวข้องกับแรงดันนั้นใช้ได้ ป, ปริมาณ วี, ปริมาณของสาร nมีหน่วยเป็นโมล ค่าคงที่ของแก๊ส รและอุณหภูมิสัมบูรณ์ ต:
ในความเท่าเทียมกันนี้ คุณสามารถทำการทดแทนได้ จากนั้นกฎของแก๊สจะแสดงผ่านค่าคงที่โบลต์ซมันน์และจำนวนโมเลกุล เอ็นในปริมาณก๊าซ วี:
ในก๊าซอุดมคติที่เป็นเนื้อเดียวกันที่อุณหภูมิสัมบูรณ์ ตพลังงานต่อระดับความเป็นอิสระในการแปลแต่ละระดับจะเท่ากัน ดังนี้จากการกระจายตัวของแมกซ์เวลล์ เคที/ 2 . ที่อุณหภูมิห้อง (300 K) พลังงานนี้คือ ![]() เจ หรือ 0.013 eV
เจ หรือ 0.013 eV
ในก๊าซอุดมคติเชิงเดี่ยว แต่ละอะตอมมีระดับความเป็นอิสระสามระดับ ซึ่งสอดคล้องกับแกนเชิงพื้นที่สามแกน ซึ่งหมายความว่าสำหรับแต่ละอะตอมจะมีพลังงานเท่ากับ 3 เคที/ 2 . ซึ่งสอดคล้องกับข้อมูลการทดลองเป็นอย่างดี เมื่อทราบพลังงานความร้อนแล้ว เราสามารถคำนวณความเร็วเฉลี่ยกำลังสองของรากของอะตอมได้ ซึ่งเป็นสัดส่วนผกผันกับรากที่สองของมวลอะตอม ความเร็วกำลังสองเฉลี่ยรากที่อุณหภูมิห้องแปรผันจาก 1370 m/s สำหรับฮีเลียม ถึง 240 m/s สำหรับซีนอน
ทฤษฎีจลน์ศาสตร์ให้สูตรสำหรับความดันเฉลี่ย ปก๊าซในอุดมคติ:
![]()
เมื่อพิจารณาว่าพลังงานจลน์เฉลี่ยของการเคลื่อนที่เป็นเส้นตรงเท่ากับ:
![]()
เราพบสมการสถานะของก๊าซในอุดมคติ:
ความสัมพันธ์นี้มีผลดีต่อก๊าซโมเลกุล อย่างไรก็ตาม การขึ้นอยู่กับความจุความร้อนจะเปลี่ยนไป เนื่องจากโมเลกุลสามารถมีระดับความอิสระภายในเพิ่มเติมโดยสัมพันธ์กับระดับความอิสระที่เกี่ยวข้องกับการเคลื่อนที่ของโมเลกุลในอวกาศ ตัวอย่างเช่น ก๊าซไดอะตอมมิกมีระดับความอิสระประมาณห้าระดับอยู่แล้ว
โดยทั่วไประบบจะอยู่ในสภาวะสมดุลโดยมีแหล่งกักเก็บความร้อนที่อุณหภูมิหนึ่ง ตมีความน่าจะเป็น พีครอบครองสถานะของพลังงาน อีซึ่งสามารถเขียนได้โดยใช้ตัวคูณเอ็กซ์โพเนนเชียล Boltzmann ที่สอดคล้องกัน:
![]()
สำนวนนี้เกี่ยวข้องกับปริมาณ เคทีด้วยมิติแห่งพลังงาน
การคำนวณความน่าจะเป็นไม่เพียงแต่ใช้สำหรับการคำนวณในทฤษฎีจลน์ของก๊าซในอุดมคติเท่านั้น แต่ยังใช้ในด้านอื่นๆ ด้วย เช่น ในจลนศาสตร์เคมีในสมการอาร์เรเนียส
บทความหลัก: เอนโทรปีทางอุณหพลศาสตร์
เอนโทรปี สของระบบเทอร์โมไดนามิกส์แบบแยกเดี่ยวในสมดุลทางอุณหพลศาสตร์ถูกกำหนดโดยลอการิทึมธรรมชาติของจำนวนไมโครสเตตต่างๆ วซึ่งสอดคล้องกับสถานะมหภาคที่กำหนด (เช่น สถานะที่มีพลังงานทั้งหมดที่กำหนด อี):
![]()
ปัจจัยสัดส่วน เคคือค่าคงที่ของโบลต์ซมันน์ นี่คือการแสดงออกที่กำหนดความสัมพันธ์ระหว่างสถานะด้วยกล้องจุลทรรศน์และระดับมหภาค (via วและเอนโทรปี สตามนั้น) เป็นการแสดงออกถึงแนวคิดหลักของกลศาสตร์เชิงสถิติและเป็นการค้นพบหลักของ Boltzmann
อุณหพลศาสตร์คลาสสิกใช้นิพจน์ Clausius สำหรับเอนโทรปี:
![]()
ดังนั้นการปรากฏตัวของค่าคงที่ Boltzmann เคสามารถเห็นได้ว่าเป็นผลมาจากการเชื่อมโยงระหว่างคำจำกัดความทางอุณหพลศาสตร์และทางสถิติของเอนโทรปี
เอนโทรปีสามารถแสดงเป็นหน่วยได้ เคซึ่งให้สิ่งต่อไปนี้:
ในหน่วยดังกล่าว เอนโทรปีสอดคล้องกับเอนโทรปีของข้อมูลทุกประการ
พลังงานลักษณะเฉพาะ เคทีเท่ากับปริมาณความร้อนที่ต้องใช้ในการเพิ่มเอนโทรปี ส“สำหรับแนทคนหนึ่ง
ต่างจากสารอื่น ๆ ในเซมิคอนดักเตอร์มีการพึ่งพาการนำไฟฟ้ากับอุณหภูมิอย่างมาก:
โดยที่ปัจจัย σ 0 ขึ้นอยู่กับอุณหภูมิค่อนข้างน้อยเมื่อเปรียบเทียบกับเลขชี้กำลัง อี เอ– พลังงานกระตุ้นการนำไฟฟ้า ความหนาแน่นของการนำอิเล็กตรอนยังขึ้นอยู่กับอุณหภูมิแบบเอ็กซ์โพเนนเชียลอีกด้วย สำหรับกระแสไฟฟ้าที่ผ่านจุดเชื่อมต่อ p-n ของเซมิคอนดักเตอร์ แทนที่จะเป็นพลังงานกระตุ้น ให้พิจารณาพลังงานเฉพาะของจุดเชื่อมต่อ p-n ที่กำหนดที่อุณหภูมิ ตเป็นพลังงานลักษณะเฉพาะของอิเล็กตรอนในสนามไฟฟ้า:
ที่ไหน ถาม- , เอ วี ทีมีความเครียดจากความร้อนขึ้นอยู่กับอุณหภูมิ
ความสัมพันธ์นี้เป็นพื้นฐานสำหรับการแสดงค่าคงที่ของ Boltzmann ในหน่วยของ eV·K −1 ที่อุณหภูมิห้อง (300 K) ค่าแรงดันความร้อนจะอยู่ที่ประมาณ 25.85 มิลลิโวลต์ 26 mV
ในทฤษฎีคลาสสิก มักใช้สูตร โดยความเร็วที่มีประสิทธิผลของตัวพาประจุในสารจะเท่ากับผลคูณของการเคลื่อนที่ของตัวพา μ และความแรงของสนามไฟฟ้า อีกสูตรหนึ่งเกี่ยวข้องกับความหนาแน่นฟลักซ์พาหะกับค่าสัมประสิทธิ์การแพร่ ดีและด้วยการไล่ระดับความเข้มข้นของตัวพา n :
![]()
ตามความสัมพันธ์ของไอน์สไตน์-สโมลูโควสกี ค่าสัมประสิทธิ์การแพร่สัมพันธ์กับการเคลื่อนที่:
![]()
ค่าคงที่ของ Boltzmann เคยังรวมอยู่ในกฎหมาย Wiedemann-Franz ซึ่งอัตราส่วนของค่าสัมประสิทธิ์การนำความร้อนต่อค่าสัมประสิทธิ์การนำไฟฟ้าในโลหะเป็นสัดส่วนกับอุณหภูมิและกำลังสองของอัตราส่วนของค่าคงที่ Boltzmann ต่อประจุไฟฟ้า
เพื่อกำหนดขอบเขตขอบเขตอุณหภูมิที่อธิบายพฤติกรรมของสสารด้วยวิธีควอนตัมหรือคลาสสิก อุณหภูมิ Debye จะถูกใช้:
![]()
ที่ไหน - , ![]() คือความถี่จำกัดของการสั่นสะเทือนแบบยืดหยุ่นของโครงตาข่ายคริสตัล ยู– ความเร็วของเสียงในร่างกายที่มั่นคง n– ความเข้มข้นของอะตอม
คือความถี่จำกัดของการสั่นสะเทือนแบบยืดหยุ่นของโครงตาข่ายคริสตัล ยู– ความเร็วของเสียงในร่างกายที่มั่นคง n– ความเข้มข้นของอะตอม
ค่าคงที่ของโบลทซ์มันน์ (k (\displaystyle k)หรือ k B (\displaystyle k_(\rm (B)))) - ค่าคงที่ทางกายภาพที่กำหนดความสัมพันธ์ระหว่างอุณหภูมิและพลังงาน ตั้งชื่อตามนักฟิสิกส์ชาวออสเตรีย ลุดวิก โบลต์ซมันน์ ซึ่งมีส่วนสำคัญในวิชาฟิสิกส์เชิงสถิติ โดยค่าคงที่นี้มีบทบาทสำคัญ ค่าทดลองในระบบหน่วยสากล (SI) คือ:
k = 1.380 648 52 (79) × 10 − 23 (\displaystyle k=1(,)380\,648\,52(79)\times 10^(-23))เจ/.ตัวเลขในวงเล็บแสดงถึงข้อผิดพลาดมาตรฐานในหลักสุดท้ายของค่าปริมาณ
1 / 3
✪ Maxwell - การกระจาย Boltzmann (ตอนที่ 6) | อุณหพลศาสตร์ | ฟิสิกส์
√ บทเรียน 433 เอฟเฟกต์ภาพถ่าย กฎของเอฟเฟกต์โฟโตอิเล็กทริค
útวิธีเปลี่ยนขาวเป็นดำ เป็นธรรมชาติ!
ในก๊าซอุดมคติที่เป็นเนื้อเดียวกันที่อุณหภูมิสัมบูรณ์ T (\displaystyle T)พลังงานต่อระดับความเป็นอิสระในการแปลแต่ละระดับจะเท่ากัน ดังนี้จากการกระจายตัวของแมกซ์เวลล์ k T / 2 (\displaystyle kT/2)- ที่อุณหภูมิห้อง (300 ) พลังงานนี้คือ 2 , 07 × 10 − 21 (\รูปแบบการแสดงผล 2(,)07\คูณ 10^(-21))เจ หรือ 0.013 eV ในก๊าซอุดมคติเชิงเดี่ยว แต่ละอะตอมมีระดับความเป็นอิสระสามระดับซึ่งสอดคล้องกับแกนเชิงพื้นที่สามแกน ซึ่งหมายความว่าแต่ละอะตอมมีพลังงาน 3 2 k T (\displaystyle (\frac (3)(2))kT).
เมื่อทราบพลังงานความร้อนแล้ว เราสามารถคำนวณความเร็วเฉลี่ยกำลังสองของรากของอะตอมได้ ซึ่งเป็นสัดส่วนผกผันกับรากที่สองของมวลอะตอม ความเร็วกำลังสองเฉลี่ยรากที่อุณหภูมิห้องแปรผันจาก 1370 m/s สำหรับฮีเลียม ถึง 240 m/s สำหรับซีนอน ในกรณีของก๊าซโมเลกุล สถานการณ์จะซับซ้อนมากขึ้น เช่น ก๊าซไดอะตอมมิกมีระดับอิสระ 5 องศา (ที่อุณหภูมิต่ำ เมื่อการสั่นสะเทือนของอะตอมในโมเลกุลไม่ตื่นเต้น)
เอนโทรปีของระบบอุณหพลศาสตร์ถูกกำหนดให้เป็นลอการิทึมธรรมชาติของจำนวนไมโครสเตตต่างๆ Z (\displaystyle Z)ซึ่งสอดคล้องกับสถานะมหภาคที่กำหนด (เช่น สถานะที่มีพลังงานทั้งหมดที่กำหนด)
S = k ln Z . (\displaystyle S=k\ln Z)ปัจจัยสัดส่วน k (\displaystyle k)และเป็นค่าคงที่ของ Boltzmann นี่คือการแสดงออกที่กำหนดความสัมพันธ์ระหว่างกล้องจุลทรรศน์ ( Z (\displaystyle Z)) และสถานะมหภาค ( เอส (\displaystyle S)) เป็นการแสดงออกถึงแนวคิดหลักของกลศาสตร์ทางสถิติ
การประชุมใหญ่สามัญว่าด้วยการชั่งน้ำหนักและมาตรการ ครั้งที่ XXIV ซึ่งจัดขึ้นในวันที่ 17-21 ตุลาคม พ.ศ. 2554 ได้มีมติที่เสนอโดยเฉพาะอย่างยิ่งว่า การแก้ไขระบบหน่วยระหว่างประเทศในอนาคตควรดำเนินการในลักษณะที่จะ แก้ไขค่าคงที่ของ Boltzmann หลังจากนั้นจะถือว่าแน่นอน อย่างแน่นอน- เป็นผลให้มันจะถูกดำเนินการ ที่แน่นอนความเท่าเทียมกัน เค=1.380 6X⋅10 −23 J/K โดยที่ X หมายถึงตัวเลขที่มีนัยสำคัญตั้งแต่หนึ่งตัวขึ้นไป ซึ่งจะพิจารณาเพิ่มเติมตามคำแนะนำของ CODATA ที่แม่นยำที่สุด การตรึงที่ถูกกล่าวหานี้เกี่ยวข้องกับความปรารถนาที่จะกำหนดหน่วยของอุณหภูมิเคลวินทางอุณหพลศาสตร์ใหม่ โดยเชื่อมโยงค่าของมันกับค่าคงที่ของ Boltzmann
ตั้งชื่อตามนักฟิสิกส์ชาวออสเตรีย ลุดวิก โบลต์ซมันน์ ซึ่งมีส่วนสำคัญในวิชาฟิสิกส์เชิงสถิติ โดยค่าคงที่นี้มีบทบาทสำคัญ ค่าทดลองในระบบ SI คือ
เจ/.ตัวเลขในวงเล็บแสดงถึงข้อผิดพลาดมาตรฐานในหลักสุดท้ายของค่าปริมาณ โดยหลักการแล้ว ค่าคงที่ของโบลต์ซมันน์สามารถหาได้จากคำนิยามของอุณหภูมิสัมบูรณ์และค่าคงที่ทางกายภาพอื่นๆ อย่างไรก็ตาม การคำนวณค่าคงที่ของ Boltzmann โดยใช้หลักการแรกนั้นซับซ้อนเกินไปและเป็นไปไม่ได้กับสถานะความรู้ในปัจจุบัน ในระบบธรรมชาติของหน่วยพลังค์ จะมีการกำหนดหน่วยอุณหภูมิตามธรรมชาติเพื่อให้ค่าคงที่ของโบลต์ซมันน์เท่ากับความสามัคคี
ในก๊าซอุดมคติที่เป็นเนื้อเดียวกันที่อุณหภูมิสัมบูรณ์ ตพลังงานต่อระดับความเป็นอิสระในการแปลแต่ละระดับจะเท่ากัน ดังนี้ จากการกระจายตัวของแมกซ์เวลล์ เคต/ 2 . ที่อุณหภูมิห้อง (300 ) พลังงานนี้คือ ![]() เจ หรือ 0.013 eV ในก๊าซอุดมคติเชิงเดี่ยว แต่ละอะตอมมีระดับความอิสระสามระดับซึ่งสอดคล้องกับแกนเชิงพื้นที่สามแกน ซึ่งหมายความว่าแต่ละอะตอมมีพลังงาน 3/2( เคต)
.
เจ หรือ 0.013 eV ในก๊าซอุดมคติเชิงเดี่ยว แต่ละอะตอมมีระดับความอิสระสามระดับซึ่งสอดคล้องกับแกนเชิงพื้นที่สามแกน ซึ่งหมายความว่าแต่ละอะตอมมีพลังงาน 3/2( เคต)
.
เมื่อทราบพลังงานความร้อนแล้ว เราสามารถคำนวณความเร็วเฉลี่ยกำลังสองของรากของอะตอมได้ ซึ่งเป็นสัดส่วนผกผันกับรากที่สองของมวลอะตอม ความเร็วกำลังสองเฉลี่ยรากที่อุณหภูมิห้องแปรผันจาก 1370 m/s สำหรับฮีเลียม ถึง 240 m/s สำหรับซีนอน ในกรณีของก๊าซโมเลกุล สถานการณ์จะซับซ้อนมากขึ้น เช่น ก๊าซไดอะตอมมิกมีระดับความอิสระประมาณห้าระดับอยู่แล้ว
เอนโทรปีของระบบอุณหพลศาสตร์ถูกกำหนดให้เป็นลอการิทึมธรรมชาติของจำนวนไมโครสเตตต่างๆ ซีซึ่งสอดคล้องกับสถานะมหภาคที่กำหนด (เช่น สถานะที่มีพลังงานทั้งหมดที่กำหนด)
ส = เค ln ซี.ปัจจัยสัดส่วน เคและเป็นค่าคงที่ของ Boltzmann นี่คือการแสดงออกที่กำหนดความสัมพันธ์ระหว่างกล้องจุลทรรศน์ ( ซี) และสถานะมหภาค ( ส) เป็นการแสดงออกถึงแนวคิดหลักของกลศาสตร์ทางสถิติ
มูลนิธิวิกิมีเดีย 2010.
ค่าคงที่ทางกายภาพ k เท่ากับอัตราส่วนของค่าคงที่ก๊าซสากล R ต่อเลขอาโวกาโดร NA: k = R/NA = 1.3807.10 23 J/K ตั้งชื่อตาม L. Boltzmann... พจนานุกรมสารานุกรมขนาดใหญ่
ค่าคงที่ทางกายภาพพื้นฐานอย่างหนึ่ง เท่ากับอัตราส่วนของค่าคงที่ของก๊าซ R ต่อค่าคงที่ Avogadro NA ซึ่งเขียนแทนด้วย k; ตั้งชื่อตามชาวออสเตรีย นักฟิสิกส์ แอล. โบลต์ซมันน์ bp รวมอยู่ในความสัมพันธ์ที่สำคัญที่สุดของฟิสิกส์จำนวนหนึ่ง: ในสมการ... ... สารานุกรมทางกายภาพ
โบลซ์มันน์ คอนสแตนต์- (k) กายภาพสากล ค่าคงที่เท่ากับอัตราส่วนของก๊าซสากล (ดู) ต่อค่าคงที่ Avogadro NA: k = R/Na = (1.380658 ± 000012)∙10 23 J/K ... สารานุกรมโพลีเทคนิคขนาดใหญ่
ค่าคงที่ทางกายภาพ k เท่ากับอัตราส่วนของค่าคงที่ก๊าซสากล R ต่อเลขอาโวกาโดร NA: k = R/NA = 1.3807·10 23 J/K ตั้งชื่อตามแอล. โบลทซ์มันน์ * * * ค่าคงที่ของ BOLTZMANN ค่าคงที่ของ BOLTZMANN ค่าคงที่ทางกายภาพ k เท่ากับ... ... พจนานุกรมสารานุกรม
ฟิสิกส์ ค่าคงที่ k เท่ากับอัตราส่วนของสากล ค่าคงที่ของก๊าซ R เท่ากับเลขอาโวกาโดร NA: k = R/NA = 1.3807 x 10 23 J/K ตั้งชื่อตาม L. Boltzmann... วิทยาศาสตร์ธรรมชาติ. พจนานุกรมสารานุกรม
ค่าคงที่ทางกายภาพพื้นฐานค่าหนึ่ง (ดูค่าคงที่ทางกายภาพ) เท่ากับอัตราส่วนของค่าคงที่ก๊าซสากล R ต่อเลข Avogadro NA (จำนวนโมเลกุลใน 1 โมลหรือ 1 กิโลเมตรโมลของสาร): k = R/NA ตั้งชื่อตามแอล. โบลทซ์มันน์ บีพี.... ... สารานุกรมผู้ยิ่งใหญ่แห่งสหภาพโซเวียต