Teoretický materiál Nakoniec môžete požiadať o radu odborníka
Prosíme, odovzdajte tento rukopis redakcii - úvodné slovo („Pýtam sa vás“); Prosím, povedz mi, aký je odvážny! - celý...
Boltzmannova konštanta (k (\displaystyle k) alebo kB (\displaystyle k_(\rm (B)))) - fyzikálna konštanta, ktorá definuje vzťah medzi teplotou a energiou. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej hrá táto konštanta kľúčovú úlohu. Jeho hodnota v Medzinárodnej sústave jednotiek SI podľa zmien v definíciách základných jednotiek SI sa presne rovná
k = 1 380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\krát 10^(-23)) J/.V homogénnom ideálnom plyne pri absolútnej teplote T (\displaystyle T), energia na každý translačný stupeň voľnosti je rovnaká, ako vyplýva z Maxwellovho rozdelenia, k T / 2 (\displaystyle kT/2). Pri izbovej teplote (300 ) je táto energia 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J alebo 0,013 eV. V monatomickom ideálnom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu 3 2 kT (\displaystyle (\frac (3)(2))kT).
Keď poznáme tepelnú energiu, môžeme vypočítať strednú odmocninu rýchlosti atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmotnosti. Stredná kvadratická rýchlosť pri izbovej teplote sa pohybuje od 1370 m/s pre hélium do 240 m/s pre xenón. V prípade molekulového plynu sa situácia komplikuje, napríklad dvojatómový plyn má 5 stupňov voľnosti - 3 translačné a 2 rotačné (pri nízkych teplotách, keď nie sú excitované vibrácie atómov v molekule a ďalšie stupne voľnosti). sloboda sa nepridáva).
Entropia termodynamického systému je definovaná ako prirodzený logaritmus počtu rôznych mikrostavov Z (\displaystyle Z), zodpovedajúce danému makroskopickému stavu (napríklad stavu s danou celkovou energiou).
S = klnZ. (\displaystyle S=k\ln Z.)Faktor proporcionality k (\displaystyle k) a je Boltzmannovou konštantou. Toto je výraz, ktorý definuje vzťah medzi mikroskopickými ( Z (\displaystyle Z)) a makroskopické stavy ( S (\displaystyle S)), vyjadruje ústrednú myšlienku štatistickej mechaniky.
Podľa Stefan-Boltzmannovho zákona hustota integrálneho pologuľového žiarenia E 0 závisí len od teploty a mení sa úmerne štvrtej mocnine absolútnej teploty T:
Stefanova-Boltzmannova konštanta σ 0 je fyzikálna konštanta zahrnutá v zákone, ktorá určuje objemovú hustotu rovnovážneho tepelného žiarenia absolútne čierneho telesa:

Historicky bol Stefan-Boltzmannov zákon formulovaný pred Planckovým radiačným zákonom, z ktorého ako dôsledok vyplýva. Planckov zákon stanovuje závislosť spektrálnej hustoty toku žiarenia E 0 na vlnovej dĺžke λ a teplote T:

kde λ – vlnová dĺžka, m; s=2,998 10 8 m/s – rýchlosť svetla vo vákuu; T– telesná teplota, K;
h= 6,625 × 10 -34 J × s – Planckova konštanta.
Fyzikálna konštanta k, rovná pomeru univerzálnej plynovej konštanty R=8314J/(kg×K) k Avogadrovmu číslu N.A.=6,022 × 1026 1/(kg × mol):

Počet rôznych konfigurácií systému od Nčastice pre danú množinu čísel n i(počet častíc v i-stav, ktorému zodpovedá energia e i) je úmerný hodnote:

Rozsah W existuje viacero spôsobov distribúcie Nčastice podľa energetických hladín. Ak je vzťah (6) pravdivý, potom sa predpokladá, že pôvodný systém sa riadi Boltzmannovou štatistikou. Sada čísel n i, pri ktorom je číslo W maximum, vyskytuje sa najčastejšie a zodpovedá najpravdepodobnejšiemu rozdeleniu.
Fyzikálna kinetika– mikroskopická teória procesov v štatisticky nerovnovážnych systémoch.
Opis veľkého počtu častíc možno úspešne uskutočniť pomocou pravdepodobnostných metód. Pre monatomický plyn je stav množiny molekúl určený ich súradnicami a hodnotami projekcií rýchlosti na zodpovedajúcich súradnicových osiach. Matematicky to popisuje distribučná funkcia, ktorá charakterizuje pravdepodobnosť, že častica bude v danom stave:

je očakávaný počet molekúl v objeme dd, ktorých súradnice sú v rozsahu od do +d a ktorých rýchlosti sú v rozsahu od do +d.
Ak možno zanedbať časovo spriemerovanú potenciálnu energiu interakcie molekúl v porovnaní s ich kinetickou energiou, potom sa plyn nazýva ideálny. Ideálny plyn sa nazýva Boltzmannov plyn, ak pomer voľnej dráhy molekúl v tomto plyne k charakteristickej veľkosti prietoku L samozrejme, t.j.

pretože dĺžka dráhy je nepriamo úmerná nd 2(n je numerická hustota 1/m 3, d je priemer molekuly, m).
Veľkosť
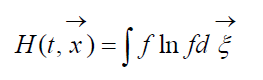
volal H-Boltzmannova funkcia pre jednotkový objem, ktorá je spojená s pravdepodobnosťou detekcie sústavy molekúl plynu v danom stave. Každý stav zodpovedá určitému počtu vyplnených šesťrozmerných buniek priestorovej rýchlosti, do ktorých možno rozdeliť fázový priestor uvažovaných molekúl. Označme W pravdepodobnosť, že v prvej bunke uvažovaného priestoru bude molekúl N 1, v druhej bunke N 2 atď.
Až do konštanty, ktorá určuje pôvod pravdepodobnosti, platí nasledujúci vzťah:
 ,
,
Kde  – H-funkcia oblasti priestoru A obsadené plynom. Z (9) je zrejmé, že W A H vzájomne prepojené, t.j. zmena pravdepodobnosti stavu vedie k zodpovedajúcemu vývoju funkcie H.
– H-funkcia oblasti priestoru A obsadené plynom. Z (9) je zrejmé, že W A H vzájomne prepojené, t.j. zmena pravdepodobnosti stavu vedie k zodpovedajúcemu vývoju funkcie H.

Boltzmannov princíp vytvára spojenie medzi entropiou S fyzikálny systém a termodynamická pravdepodobnosť W jej stavy:

(vydané podľa publikácie: Kogan M.N. Dynamics of a rarefied gas. - M.: Nauka, 1967.)
Celkový pohľad na CUBE:

kde je hmotnostná sila v dôsledku prítomnosti rôznych polí (gravitačných, elektrických, magnetických) pôsobiacich na molekulu; J– kolízny integrál. Práve tento člen Boltzmannovej rovnice berie do úvahy vzájomné zrážky molekúl a zodpovedajúce zmeny rýchlostí interagujúcich častíc. Kolízny integrál je päťrozmerný integrál a má nasledujúcu štruktúru:

Rovnica (12) s integrálom (13) bola získaná pre zrážky molekúl, pri ktorých nevznikajú tangenciálne sily, t.j. kolidujúce častice sa považujú za dokonale hladké.
Pri interakcii sa vnútorná energia molekúl nemení, t.j. predpokladá sa, že tieto molekuly sú dokonale elastické. Uvažujeme dve skupiny molekúl, ktoré majú rýchlosti a pred vzájomnou zrážkou (zrážkou) (obr. 1), a po zrážke, resp. Rozdiel v rýchlosti sa nazýva relatívna rýchlosť, t.j. . Je jasné, že pre hladkú elastickú zrážku . Distribučné funkcie f 1 ", f", f 1, f opisujú molekuly zodpovedajúcich skupín po a pred zrážkami, t.j. ; ![]() ;
; ![]() ;
; ![]() .
.

Ryža. 1. Zrážka dvoch molekúl.
(13) zahŕňa dva parametre charakterizujúce umiestnenie kolidujúcich molekúl voči sebe navzájom: b a e; b– zameriavacia vzdialenosť, t.j. najmenšia vzdialenosť, na ktorú by sa molekuly priblížili v neprítomnosti interakcie (obr. 2); ε sa nazýva kolízny uhlový parameter (obr. 3). Integrácia ukončená b od 0 do ¥ a od 0 do 2p (dva externé integrály v (12)) pokrýva celú rovinu silovej interakcie kolmú na vektor

Ryža. 2. Trajektória pohybu molekúl.

Ryža. 3. Úvaha o interakcii molekúl vo cylindrickom súradnicovom systéme: z, b, ε
Boltzmannova kinetická rovnica je odvodená z nasledujúcich predpokladov a predpokladov.
1. Predpokladá sa, že dochádza najmä ku zrážkam dvoch molekúl, t.j. úloha zrážok troch alebo viacerých molekúl súčasne je nevýznamná. Tento predpoklad nám umožňuje použiť na analýzu distribučnú funkciu jednej častice, ktorá sa vyššie nazýva jednoducho distribučná funkcia. Zohľadnenie kolízie troch molekúl vedie k potrebe použiť v štúdii funkciu distribúcie dvoch častíc. V dôsledku toho sa analýza výrazne skomplikuje.
2. Predpoklad molekulárneho chaosu. Vyjadruje sa v skutočnosti, že pravdepodobnosti detekcie častice 1 vo fázovom bode a častice 2 vo fázovom bode sú navzájom nezávislé.
3. Rovnako pravdepodobné sú zrážky molekúl s akoukoľvek dopadovou vzdialenosťou, t.j. distribučná funkcia sa pri interakčnom priemere nemení. Treba poznamenať, že analyzovaný prvok musí byť malý, aby f v rámci tohto prvku sa nemení, ale zároveň tak, aby relatívna fluktuácia ~ nebola veľká. Interakčné potenciály použité pri výpočte kolízneho integrálu sú sféricky symetrické, t.j. ![]() .
.
Rovnovážny stav plynu je opísaný absolútnym Maxwellovým rozdelením, ktoré je presným riešením Boltzmannovej kinetickej rovnice:

kde m je hmotnosť molekuly, kg.
Všeobecná lokálna Maxwellova distribúcia, inak nazývaná Maxwell-Boltzmannova distribúcia:

v prípade, keď sa plyn pohybuje ako celok rýchlosťou a premenné n, T závisia od súradnice
a čas t.
V gravitačnom poli Zeme presné riešenie Boltzmannovej rovnice ukazuje:
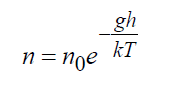
Kde n 0 = hustota na povrchu Zeme, 1/m3; g– tiažové zrýchlenie, m/s 2 ; h– výška, m Vzorec (16) je presným riešením Boltzmannovej kinetickej rovnice buď v neobmedzenom priestore, alebo za prítomnosti hraníc, ktoré toto rozdelenie neporušujú, pričom teplota musí tiež zostať konštantná.
Túto stránku navrhla Puzina Yu.Yu. s podporou Ruskej nadácie pre základný výskum - projekt č. 08-08-00638.
Pre konštantu súvisiacu s energiou žiarenia čierneho telesa pozri Stefan-Boltzmannovu konštantu
|
Konštantná hodnota k |
Rozmer |
|
1,380 6504(24) 10 −23 |
|
|
8,617 343(15) 10 −5 |
|
|
1,3807 10 −16 |
|
|
Pozri tiež Hodnoty v rôznych jednotkách nižšie. |
|
Boltzmannova konštanta (k alebo k B) je fyzikálna konštanta, ktorá určuje vzťah medzi teplotou látky a energiou tepelného pohybu častíc tejto látky. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej hrá táto konštanta kľúčovú úlohu. Jeho experimentálna hodnota v sústave SI je
V tabuľke posledné číslice v zátvorkách označujú štandardnú chybu konštantnej hodnoty. Boltzmannovu konštantu možno v zásade získať z definície absolútnej teploty a iných fyzikálnych konštánt. Presný výpočet Boltzmannovej konštanty pomocou prvých princípov je však príliš zložitý a pri súčasnom stave poznania nerealizovateľný.
Boltzmannovu konštantu je možné určiť experimentálne pomocou Planckovho zákona tepelného žiarenia, ktorý popisuje rozloženie energie v spektre rovnovážneho žiarenia pri určitej teplote emitujúceho telesa, ako aj inými metódami.
Medzi univerzálnou plynovou konštantou a Avogadrovým číslom existuje vzťah, z ktorého vyplýva hodnota Boltzmannovej konštanty:
Rozmer Boltzmannovej konštanty je rovnaký ako rozmer entropie.
|
V roku 1877 Boltzmann ako prvý spojil entropiu a pravdepodobnosť, ale pomerne presnú hodnotu konštanty k ako väzbový koeficient vo vzorci pre entropiu sa objavil až v prácach M. Plancka. Pri odvodení zákona žiarenia čierneho telesa Planck v rokoch 1900–1901. pre Boltzmannovu konštantu zistil hodnotu 1,346 10 −23 J/K, takmer o 2,5 % menej ako v súčasnosti akceptovaná hodnota.
Pred rokom 1900 sa vzťahy, ktoré sa teraz píšu s Boltzmannovou konštantou, zapisovali pomocou plynovej konštanty R a namiesto priemernej energie na molekulu sa použila celková energia látky. Lakonický vzorec formulára S = k log W na buste Boltzmanna sa takou stala vďaka Planckovi. Vo svojej Nobelovej prednáške v roku 1920 Planck napísal:
Táto konštanta sa často nazýva Boltzmannovou konštantou, hoci, pokiaľ viem, sám Boltzmann ju nikdy nezaviedol – zvláštny stav, napriek tomu, že Boltzmannove vyjadrenia nehovorili o presnom meraní tejto konštanty.
Túto situáciu možno vysvetliť v tom čase prebiehajúcou vedeckou diskusiou s cieľom objasniť podstatu atómovej štruktúry hmoty. V druhej polovici 19. storočia panovali značné nezhody v tom, či sú atómy a molekuly skutočné alebo len pohodlný spôsob opisu javov. Neexistoval ani konsenzus o tom, či „chemické molekuly“, odlíšené ich atómovou hmotnosťou, sú rovnaké molekuly ako v kinetickej teórii. Ďalej v Planckovej Nobelovej prednáške možno nájsť nasledovné:
„Nič nemôže lepšie demonštrovať pozitívnu a zrýchľujúcu sa rýchlosť pokroku ako umenie experimentov za posledných dvadsať rokov, keď bolo naraz objavených veľa metód na meranie hmotnosti molekúl s takmer rovnakou presnosťou ako meranie hmotnosti planéty. “
Pre ideálny plyn platí jednotný plynový zákon o tlaku P, objem V, množstvo hmoty n v móloch, plynová konštanta R a absolútna teplota T:
V tejto rovnosti môžete vykonať náhradu. Potom bude zákon o plyne vyjadrený prostredníctvom Boltzmannovej konštanty a počtu molekúl N v objeme plynu V:
V homogénnom ideálnom plyne pri absolútnej teplote T, energia na každý translačný stupeň voľnosti je rovnaká, ako vyplýva z Maxwellovho rozdelenia, kT/ 2 . Pri izbovej teplote (≈ 300 K) je táto energia ![]() J alebo 0,013 eV.
J alebo 0,013 eV.
V monatomickom ideálnom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že na každý atóm pripadá energia 3 kT/ 2 . To dobre súhlasí s experimentálnymi údajmi. Keď poznáme tepelnú energiu, môžeme vypočítať strednú odmocninu rýchlosti atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmotnosti. Stredná kvadratická rýchlosť pri izbovej teplote sa pohybuje od 1370 m/s pre hélium do 240 m/s pre xenón.
Kinetická teória dáva vzorec pre priemerný tlak P ideálny plyn:
![]()
Ak vezmeme do úvahy, že priemerná kinetická energia priamočiareho pohybu sa rovná:
![]()
nájdeme stavovú rovnicu ideálneho plynu:
Tento vzťah dobre platí pre molekulárne plyny; mení sa však závislosť tepelnej kapacity, keďže molekuly môžu mať ďalšie vnútorné stupne voľnosti vo vzťahu k tým stupňom voľnosti, ktoré súvisia s pohybom molekúl v priestore. Napríklad dvojatómový plyn má už približne päť stupňov voľnosti.
Vo všeobecnosti je systém v rovnováhe so zásobníkom tepla pri teplote T má pravdepodobnosť p zaberajú stav energie E, ktorý možno zapísať pomocou zodpovedajúceho exponenciálneho Boltzmannovho multiplikátora:
![]()
Tento výraz zahŕňa množstvo kT s dimenziou energie.
Výpočet pravdepodobnosti sa používa nielen na výpočty v kinetickej teórii ideálnych plynov, ale aj v iných oblastiach, napríklad v chemickej kinetike v Arrheniovej rovnici.
Hlavný článok: Termodynamická entropia
Entropia S izolovaného termodynamického systému v termodynamickej rovnováhe je určený prirodzeným logaritmom počtu rôznych mikrostavov W zodpovedajúce danému makroskopickému stavu (napríklad stavu s danou celkovou energiou E):
![]()
Faktor proporcionality k je Boltzmannova konštanta. Toto je výraz, ktorý definuje vzťah medzi mikroskopickými a makroskopickými stavmi (cez W a entropiu S podľa toho), vyjadruje ústrednú myšlienku štatistickej mechaniky a je hlavným Boltzmannovým objavom.
Klasická termodynamika používa pre entropiu Clausiusov výraz:
![]()
Teda vzhľad Boltzmannovej konštanty k možno považovať za dôsledok prepojenia termodynamickej a štatistickej definície entropie.
Entropiu možno vyjadriť v jednotkách k, ktorý dáva nasledovné:
V takýchto jednotkách entropia presne zodpovedá informačnej entropii.
Charakteristická energia kT rovná množstvu tepla potrebnému na zvýšenie entropie S"pre jednu nat.
Na rozdiel od iných látok existuje v polovodičoch silná závislosť elektrickej vodivosti od teploty:
kde faktor σ 0 závisí od teploty pomerne slabo v porovnaní s exponenciálou, E A– vodivosť aktivačná energia. Hustota vodivých elektrónov tiež závisí exponenciálne od teploty. Pre prúd cez polovodičový p-n prechod namiesto aktivačnej energie zvážte charakteristickú energiu daného p-n prechodu pri teplote T ako charakteristická energia elektrónu v elektrickom poli:
Kde q- , A V T dochádza k tepelnému namáhaniu v závislosti od teploty.
Tento vzťah je základom pre vyjadrenie Boltzmannovej konštanty v jednotkách eV∙K −1. Pri izbovej teplote (≈ 300 K) je hodnota tepelného napätia približne 25,85 milivoltov ≈ 26 mV.
V klasickej teórii sa často používa vzorec, podľa ktorého sa efektívna rýchlosť nosičov náboja v látke rovná súčinu mobility nosiča μ a intenzity elektrického poľa. Ďalší vzorec dáva do súvislosti hustotu toku nosiča s koeficientom difúzie D a s gradientom koncentrácie nosiča n :
![]()
Podľa vzťahu Einstein-Smoluchowski súvisí difúzny koeficient s pohyblivosťou:
![]()
Boltzmannova konštanta k je zahrnutý aj vo Wiedemann-Franzovom zákone, podľa ktorého je pomer súčiniteľa tepelnej vodivosti k súčiniteľu elektrickej vodivosti v kovoch úmerný teplote a druhej mocnine pomeru Boltzmannovej konštanty k elektrickému náboju.
Na vymedzenie teplotných oblastí, v ktorých je správanie hmoty opísané kvantovými alebo klasickými metódami, sa používa Debyeova teplota:
![]()
Kde - , ![]() je medzná frekvencia elastických vibrácií kryštálovej mriežky, u- rýchlosť zvuku v pevnej látke, n- koncentrácia atómov.
je medzná frekvencia elastických vibrácií kryštálovej mriežky, u- rýchlosť zvuku v pevnej látke, n- koncentrácia atómov.
Boltzmannova konštanta (k (\displaystyle k) alebo kB (\displaystyle k_(\rm (B)))) - fyzikálna konštanta, ktorá určuje vzťah medzi teplotou a energiou. Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej hrá táto konštanta kľúčovú úlohu. Jeho experimentálna hodnota v medzinárodnom systéme jednotiek (SI) je:
k = 1 380 648 52 (79) × 10 − 23 (\displaystyle k=1(,)380\,648\,52(79)\krát 10^(-23)) J/.Čísla v zátvorkách označujú štandardnú chybu v posledných čísliciach hodnoty množstva.
1 / 3
✪ Maxwell - Boltzmannov rozvod (časť 6) | Termodynamika | fyzika
✪ Lekcia 433. Fotoefekt. Zákony fotoelektrického javu
✪ Ako zmeniť bielu na čiernu. Prirodzene!
V homogénnom ideálnom plyne pri absolútnej teplote T (\displaystyle T), energia na každý translačný stupeň voľnosti je rovnaká, ako vyplýva z Maxwellovho rozdelenia, k T / 2 (\displaystyle kT/2). Pri izbovej teplote (300 ) je táto energia 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J alebo 0,013 eV. V monatomickom ideálnom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu 3 2 kT (\displaystyle (\frac (3)(2))kT).
Keď poznáme tepelnú energiu, môžeme vypočítať strednú odmocninu rýchlosti atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmotnosti. Stredná kvadratická rýchlosť pri izbovej teplote sa pohybuje od 1370 m/s pre hélium do 240 m/s pre xenón. V prípade molekulárneho plynu sa situácia komplikuje, napríklad dvojatómový plyn má päť stupňov voľnosti (pri nízkych teplotách, keď nie sú excitované vibrácie atómov v molekule).
Entropia termodynamického systému je definovaná ako prirodzený logaritmus počtu rôznych mikrostavov Z (\displaystyle Z), zodpovedajúce danému makroskopickému stavu (napríklad stavu s danou celkovou energiou).
S = klnZ. (\displaystyle S=k\ln Z.)Faktor proporcionality k (\displaystyle k) a je Boltzmannovou konštantou. Toto je výraz, ktorý definuje vzťah medzi mikroskopickými ( Z (\displaystyle Z)) a makroskopické stavy ( S (\displaystyle S)), vyjadruje ústrednú myšlienku štatistickej mechaniky.
XXIV. generálna konferencia pre váhy a miery, ktorá sa konala v dňoch 17. – 21. októbra 2011, prijala uznesenie, v ktorom sa najmä navrhuje, aby budúca revízia Medzinárodnej sústavy jednotiek prebiehala tak, aby fixovať hodnotu Boltzmannovej konštanty, po ktorej sa bude považovať za definitívnu presne tak. V dôsledku toho bude vykonaná presné rovnosť k=1,380 6X⋅10 −23 J/K, kde X znamená jednu alebo viacero platných číslic, ktoré budú ďalej určené na základe najpresnejších odporúčaní CODATA. Táto údajná fixácia je spojená s túžbou predefinovať jednotku termodynamickej teploty kelvin, spájajúc jej hodnotu s hodnotou Boltzmannovej konštanty.
Pomenovaný po rakúskom fyzikovi Ludwigovi Boltzmannovi, ktorý významne prispel k štatistickej fyzike, v ktorej hrá táto konštanta kľúčovú úlohu. Jeho experimentálna hodnota v sústave SI je
J/.Čísla v zátvorkách označujú štandardnú chybu v posledných čísliciach hodnoty množstva. Boltzmannovu konštantu možno v zásade získať z definície absolútnej teploty a iných fyzikálnych konštánt. Výpočet Boltzmannovej konštanty pomocou prvých princípov je však príliš zložitý a pri súčasnom stave poznania nerealizovateľný. V prirodzenom systéme Planckových jednotiek je prirodzená jednotka teploty daná tak, že Boltzmannova konštanta sa rovná jednote.
V homogénnom ideálnom plyne pri absolútnej teplote T, energia na každý translačný stupeň voľnosti je rovnaká, ako vyplýva z Maxwellovho rozdelenia kT/ 2 . Pri izbovej teplote (300 ) je táto energia ![]() J alebo 0,013 eV. V monatomickom ideálnom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu 3/2( kT)
.
J alebo 0,013 eV. V monatomickom ideálnom plyne má každý atóm tri stupne voľnosti zodpovedajúce trom priestorovým osám, čo znamená, že každý atóm má energiu 3/2( kT)
.
Keď poznáme tepelnú energiu, môžeme vypočítať strednú odmocninu rýchlosti atómov, ktorá je nepriamo úmerná druhej odmocnine atómovej hmotnosti. Stredná kvadratická rýchlosť pri izbovej teplote sa pohybuje od 1370 m/s pre hélium do 240 m/s pre xenón. V prípade molekulárneho plynu sa situácia komplikuje, napríklad dvojatómový plyn má už približne päť stupňov voľnosti.
Entropia termodynamického systému je definovaná ako prirodzený logaritmus počtu rôznych mikrostavov Z, zodpovedajúce danému makroskopickému stavu (napríklad stavu s danou celkovou energiou).
S = k ln Z.Faktor proporcionality k a je Boltzmannovou konštantou. Toto je výraz, ktorý definuje vzťah medzi mikroskopickými ( Z) a makroskopické stavy ( S), vyjadruje ústrednú myšlienku štatistickej mechaniky.
Nadácia Wikimedia. 2010.
Fyzikálna konštanta k, rovná pomeru univerzálnej plynovej konštanty R k Avogadrovmu číslu NA: k = R/NA = 1,3807,10 23 J/K. Pomenovaný po L. Boltzmannovi... Veľký encyklopedický slovník
Jedna zo základných fyzikálnych konštánt; rovná pomeru plynovej konštanty R k Avogadrovej konštante NA, označovanej ako k; pomenované po Rakúšanovi fyzik L. Boltzmann. Bp je zahrnuté v niekoľkých najdôležitejších vzťahoch fyziky: v rovnici... ... Fyzická encyklopédia
BOLZMANN KONŠTANTA- k) univerzálny fyzický. konštanta rovná pomeru univerzálneho plynu (pozri) k Avogadrovej konštante NA: k = R/Na = (1,380658 ± 000012)∙10 23 J/K ... Veľká polytechnická encyklopédia
Fyzikálna konštanta k, rovná pomeru univerzálnej plynovej konštanty R k Avogadrovmu číslu NA: k = R/NA = 1,3807·10 23 J/K. Pomenovaný po L. Boltzmannovi. * * * BOLZMANN'S CONSTANT BOLZMANN'S CONSTANT, fyzikálna konštanta k, rovná sa... ... encyklopedický slovník
Phys. konštanta k, rovná pomeru univerzál. plynová konštanta R k Avogadrovmu číslu NA: k = R/NA = 1,3807 x 10 23 J/K. Pomenovaný po L. Boltzmannovi... Prírodná veda. encyklopedický slovník
Jedna zo základných fyzikálnych konštánt (pozri Fyzikálne konštanty), ktorá sa rovná pomeru univerzálnej plynovej konštanty R k Avogadrovmu číslu NA. (počet molekúl na 1 mol alebo 1 kmol látky): k = R/NA. Pomenovaný po L. Boltzmannovi. B. p....... Veľká sovietska encyklopédia