Materiale teorico Puoi finalmente chiedere consiglio ad uno specialista
Per favore, consegna questo manoscritto all'editore - una parola introduttiva ("Ti chiedo"); Per favore, dimmi quanto è coraggioso! - Totale...
Costante di Boltzmann (k (\displaystyle k) O kB (\displaystyle k_(\rm (B)))) - una costante fisica che definisce la relazione tra temperatura ed energia. Prende il nome dal fisico austriaco Ludwig Boltzmann, che diede importanti contributi alla fisica statistica, nella quale questa costante gioca un ruolo chiave. Il suo valore nel Sistema Internazionale delle Unità SI in base ai cambiamenti nelle definizioni delle unità SI di base è esattamente uguale a
k = 1.380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\times 10^(-23)) J/.In un gas ideale omogeneo a temperatura assoluta T (\displaystyle T), l'energia per ogni grado di libertà traslazionale è uguale, come segue dalla distribuzione di Maxwell, k T / 2 (\displaystyle kT/2). A temperatura ambiente (300 ) questa energia è 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J, o 0,013 eV. In un gas ideale monoatomico, ogni atomo ha tre gradi di libertà corrispondenti a tre assi spaziali, il che significa che ogni atomo ha un'energia di 3 2 kT (\displaystyle (\frac (3)(2))kT).
Conoscendo l'energia termica, possiamo calcolare la velocità quadratica media degli atomi, che è inversamente proporzionale alla radice quadrata della massa atomica. La velocità quadratica media a temperatura ambiente varia da 1370 m/s per l'elio a 240 m/s per lo xeno. Nel caso di un gas molecolare, la situazione diventa più complicata, ad esempio, un gas biatomico ha 5 gradi di libertà: 3 traslazionali e 2 rotazionali (a basse temperature, quando le vibrazioni degli atomi nella molecola non sono eccitate e ulteriori gradi di libertà libertà non vengono aggiunte).
L'entropia di un sistema termodinamico è definita come il logaritmo naturale del numero di diversi microstati Z (\displaystyle Z), corrispondente ad un dato stato macroscopico (ad esempio, uno stato con una data energia totale).
S = k ln Z . (\displaystyle S=k\ln Z.)Fattore di proporzionalità k (\displaystyle k) ed è la costante di Boltzmann. Questa è un'espressione che definisce la relazione tra microscopico ( Z (\displaystyle Z)) e stati macroscopici ( S (\displaystyle S)), esprime l'idea centrale della meccanica statistica.
Secondo la legge di Stefan-Boltzmann, la densità della radiazione emisferica integrale E0 dipende solo dalla temperatura e varia proporzionalmente alla quarta potenza della temperatura assoluta T:
La costante di Stefan–Boltzmann σ 0 è una costante fisica inclusa nella legge che determina la densità volumetrica della radiazione termica di equilibrio di un corpo assolutamente nero:

Storicamente la legge di Stefan-Boltzmann è stata formulata prima della legge sulla radiazione di Planck, dalla quale discende di conseguenza. La legge di Planck stabilisce la dipendenza dalla densità del flusso spettrale della radiazione E 0 sulla lunghezza d'onda λ e sulla temperatura T:

dove λ – lunghezza d'onda, m; Con=2.998 10 8 m/s – velocità della luce nel vuoto; T– temperatura corporea, K;
H= 6.625 ×10 -34 J×s – Costante di Planck.
Costante fisica K, pari al rapporto della costante universale dei gas R=8314J/(kg×K) al numero di Avogadro N / A.=6,022× 10 26 1/(kg×mol):

Numero di diverse configurazioni di sistema da N particelle per un dato insieme di numeri no io(numero di particelle in io-lo stato a cui corrisponde l'energia e i) è proporzionale al valore:

Grandezza W ci sono diversi modi di distribuzione N particelle per livelli energetici. Se la relazione (6) è vera, allora si considera che il sistema originale obbedisca alla statistica di Boltzmann. Insieme di numeri no io, in cui il numero W massimo, si verifica più frequentemente e corrisponde alla distribuzione più probabile.
Cinetica fisica– teoria microscopica dei processi in sistemi statisticamente non in equilibrio.
La descrizione di un gran numero di particelle può essere effettuata con successo utilizzando metodi probabilistici. Per un gas monoatomico, lo stato di un insieme di molecole è determinato dalle loro coordinate e dai valori delle proiezioni di velocità sui corrispondenti assi delle coordinate. Matematicamente, questo è descritto dalla funzione di distribuzione, che caratterizza la probabilità che una particella si trovi in un dato stato:

è il numero atteso di molecole nel volume d d, le cui coordinate sono nell'intervallo da a +d e le cui velocità sono nell'intervallo da a +d.
Se l'energia potenziale mediata nel tempo di interazione delle molecole può essere trascurata rispetto alla loro energia cinetica, allora il gas viene chiamato ideale. Un gas ideale è detto gas di Boltzmann se il rapporto tra la lunghezza del percorso delle molecole in questo gas e la dimensione caratteristica del flusso l ovviamente, cioè

Perché la lunghezza del percorso è inversamente proporzionale secondo 2(n è la densità numerica 1/m 3, d è il diametro della molecola, m).
Misurare
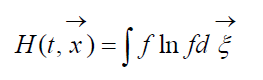
chiamato H-Funzione di Boltzmann per un'unità di volume, che è associata alla probabilità di rilevare un sistema di molecole di gas in un dato stato. Ogni stato corrisponde a un certo numero di celle di velocità spaziale esadimensionali di riempimento in cui può essere suddiviso lo spazio delle fasi delle molecole considerate. Denotiamo W la probabilità che ci siano N 1 molecole nella prima cella dello spazio considerato, N 2 nella seconda, ecc.
A meno di una costante che determina l'origine della probabilità, vale la seguente relazione:
 ,
,
Dove  – Funzione H di una regione dello spazio UN occupato dal gas. Dalla (9) è chiaro che W E H interconnessi, cioè un cambiamento nella probabilità di uno stato porta ad una corrispondente evoluzione della funzione H.
– Funzione H di una regione dello spazio UN occupato dal gas. Dalla (9) è chiaro che W E H interconnessi, cioè un cambiamento nella probabilità di uno stato porta ad una corrispondente evoluzione della funzione H.

Il principio di Boltzmann stabilisce la connessione tra entropia S sistema fisico e probabilità termodinamica W lei afferma:

(pubblicato secondo la pubblicazione: Kogan M.N. Dinamica di un gas rarefatto. - M.: Nauka, 1967.)
Vista generale del CUBO:

dove è la forza di massa dovuta alla presenza dei vari campi (gravitazionali, elettrici, magnetici) che agiscono sulla molecola; J– integrale di collisione. È questo termine dell'equazione di Boltzmann che tiene conto delle collisioni delle molecole tra loro e dei corrispondenti cambiamenti nella velocità delle particelle interagenti. L'integrale di collisione è un integrale pentadimensionale e ha la seguente struttura:

L'equazione (12) con l'integrale (13) è stata ottenuta per collisioni di molecole in cui non si verificano forze tangenziali, cioè le particelle in collisione sono considerate perfettamente lisce.
Durante l'interazione, l'energia interna delle molecole non cambia, cioè si presuppone che queste molecole siano perfettamente elastiche. Vengono considerati due gruppi di molecole, aventi velocità e prima di scontrarsi tra loro (collisione), e dopo la collisione, rispettivamente, velocità e . La differenza di velocità è chiamata velocità relativa, cioè . È chiaro che per una collisione elastica regolare . Funzioni di distribuzione f1", f", f1, f descrivi le molecole dei gruppi corrispondenti dopo e prima delle collisioni, cioè ; ![]() ;
; ![]() ;
; ![]() .
.

Riso. 1. Collisione di due molecole.
(13) include due parametri che caratterizzano la posizione delle molecole in collisione l'una rispetto all'altra: B ed ε; B– distanza di mira, cioè la distanza più piccola alla quale le molecole si avvicinerebbero in assenza di interazione (Fig. 2); ε è chiamato parametro angolare di collisione (Fig. 3). Integrazione finita B da 0 a ¥ e da 0 a 2p (due integrali esterni nella (12)) copre l'intero piano di interazione delle forze perpendicolare al vettore

Riso. 2. La traiettoria delle molecole.

Riso. 3. Considerazione dell'interazione delle molecole in un sistema di coordinate cilindriche: z, B, ε
L'equazione cinetica di Boltzmann è derivata dalle seguenti ipotesi e ipotesi.
1. Si ritiene che si verifichino principalmente collisioni di due molecole, ad es. il ruolo delle collisioni di tre o più molecole contemporaneamente è insignificante. Questo presupposto ci consente di utilizzare per l'analisi una funzione di distribuzione di particella singola, che sopra è semplicemente chiamata funzione di distribuzione. Prendere in considerazione la collisione di tre molecole porta alla necessità di utilizzare nello studio una funzione di distribuzione a due particelle. Di conseguenza, l’analisi diventa notevolmente più complicata.
2. Presupposto del caos molecolare. Ciò si esprime nel fatto che le probabilità di rilevare la particella 1 nel punto di fase e la particella 2 nel punto di fase sono indipendenti l'una dall'altra.
3. Le collisioni di molecole con qualsiasi distanza di impatto sono ugualmente probabili, ad es. la funzione di distribuzione non cambia al diametro di interazione. Va notato che l'elemento analizzato deve essere piccolo in modo che F all'interno di questo elemento non cambia, ma allo stesso tempo in modo che la fluttuazione relativa ~ non sia grande. I potenziali di interazione utilizzati nel calcolo dell'integrale di collisione sono sfericamente simmetrici, cioè ![]() .
.
Lo stato di equilibrio del gas è descritto dalla distribuzione Maxwelliana assoluta, che è una soluzione esatta dell'equazione cinetica di Boltzmann:

dove m è la massa della molecola, kg.
La distribuzione Maxwelliana locale generale, altrimenti chiamata distribuzione Maxwell-Boltzmann:

nel caso in cui il gas si muove complessivamente con velocità e le variabili n, T dipendono dalla coordinata
e il tempo t.
Nel campo gravitazionale della Terra, la soluzione esatta dell'equazione di Boltzmann mostra:
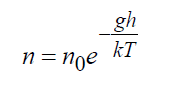
Dove N 0 = densità sulla superficie terrestre, 1/m3; G– accelerazione di gravità, m/s 2 ; H– altezza, m. La formula (16) è una soluzione esatta dell'equazione cinetica di Boltzmann sia in spazio illimitato sia in presenza di confini che non violano questa distribuzione, mentre anche la temperatura deve rimanere costante.
Questa pagina è stata progettata da Puzina Yu.Yu. con il sostegno della Fondazione russa per la ricerca di base - progetto n. 08-08-00638.
Per una costante correlata all'energia della radiazione del corpo nero, vedere Costante di Stefan-Boltzmann
|
Valore costante K |
Dimensione |
|
1,380 6504(24) 10 −23 |
|
|
8,617 343(15) 10 −5 |
|
|
1,3807 10 −16 |
|
|
Vedi anche Valori in varie unità di seguito. |
|
Costante di Boltzmann (K O K B) è una costante fisica che determina la relazione tra la temperatura di una sostanza e l'energia del movimento termico delle particelle di questa sostanza. Prende il nome dal fisico austriaco Ludwig Boltzmann, che diede importanti contributi alla fisica statistica, nella quale questa costante gioca un ruolo chiave. Il suo valore sperimentale nel sistema SI è
Nella tabella gli ultimi numeri tra parentesi indicano l'errore standard del valore costante. In linea di principio, la costante di Boltzmann può essere ottenuta dalla definizione di temperatura assoluta e di altre costanti fisiche. Tuttavia, calcolare accuratamente la costante di Boltzmann utilizzando i principi primi è troppo complesso e irrealizzabile allo stato attuale delle conoscenze.
La costante di Boltzmann può essere determinata sperimentalmente utilizzando la legge della radiazione termica di Planck, che descrive la distribuzione dell'energia nello spettro della radiazione di equilibrio ad una determinata temperatura del corpo emittente, così come altri metodi.
Esiste una relazione tra la costante universale dei gas e il numero di Avogadro, da cui segue il valore della costante di Boltzmann:
La dimensione della costante di Boltzmann è la stessa dell'entropia.
|
Nel 1877, Boltzmann fu il primo a collegare entropia e probabilità, ma un valore abbastanza accurato della costante K come coefficiente di accoppiamento nella formula dell'entropia è apparso solo nei lavori di M. Planck. Nel derivare la legge della radiazione del corpo nero, Planck nel 1900-1901. per la costante di Boltzmann trovò un valore di 1.346 · 10 −23 J/K, quasi il 2,5% in meno rispetto al valore attualmente accettato.
Prima del 1900, le relazioni che oggi vengono scritte con la costante di Boltzmann venivano scritte utilizzando la costante dei gas R, e invece dell'energia media per molecola, è stata utilizzata l'energia totale della sostanza. Formula laconica della forma S = K tronco d'albero W sul busto di Boltzmann divenne tale grazie a Planck. Nella sua conferenza per il Nobel nel 1920, Planck scrisse:
Questa costante è spesso chiamata costante di Boltzmann, anche se, per quanto ne so, Boltzmann stesso non l'ha mai introdotta: uno strano stato di cose, nonostante il fatto che le dichiarazioni di Boltzmann non parlino della misurazione esatta di questa costante.
Questa situazione può essere spiegata dal dibattito scientifico in corso in quel periodo per chiarire l'essenza della struttura atomica della materia. Nella seconda metà del XIX secolo esisteva un notevole disaccordo sulla questione se gli atomi e le molecole fossero reali o semplicemente un modo conveniente per descrivere i fenomeni. Inoltre non c'era consenso sul fatto che le "molecole chimiche" distinte dalla loro massa atomica fossero le stesse molecole della teoria cinetica. Inoltre nella conferenza Nobel di Planck si può trovare quanto segue:
“Niente può dimostrare meglio il ritmo positivo e accelerato del progresso dell’arte della sperimentazione durante gli ultimi vent’anni, quando sono stati scoperti contemporaneamente molti metodi per misurare la massa delle molecole con quasi la stessa precisione con cui si misura la massa di un pianeta. "
Per un gas ideale vale la legge unificata dei gas relativa alla pressione P, volume V, ammontare della sostanza N in moli, costante dei gas R e temperatura assoluta T:
In questa uguaglianza, puoi effettuare una sostituzione. Successivamente la legge dei gas verrà espressa attraverso la costante di Boltzmann e il numero di molecole N nel volume del gas V:
In un gas ideale omogeneo a temperatura assoluta T, l'energia per ciascun grado di libertà traslazionale è uguale, come segue dalla distribuzione di Maxwell, kT/2. A temperatura ambiente (≈ 300 K) questa energia è ![]() J, o 0,013 eV.
J, o 0,013 eV.
In un gas ideale monoatomico ogni atomo ha tre gradi di libertà corrispondenti a tre assi spaziali, il che significa che ogni atomo ha un'energia pari a 3 kT/2. Ciò concorda bene con i dati sperimentali. Conoscendo l'energia termica, possiamo calcolare la velocità quadratica media degli atomi, che è inversamente proporzionale alla radice quadrata della massa atomica. La velocità quadratica media a temperatura ambiente varia da 1370 m/s per l'elio a 240 m/s per lo xeno.
La teoria cinetica fornisce una formula per la pressione media P gas ideale:
![]()
Considerando che l’energia cinetica media del moto rettilineo è pari a:
![]()
troviamo l'equazione di stato di un gas ideale:
Questa relazione vale anche per i gas molecolari; tuttavia, la dipendenza della capacità termica cambia, poiché le molecole possono avere ulteriori gradi di libertà interni rispetto a quei gradi di libertà associati al movimento delle molecole nello spazio. Ad esempio, un gas biatomico ha già circa cinque gradi di libertà.
In generale, il sistema è in equilibrio con un serbatoio di calore a temperatura T ha una probabilità P occupare uno stato energetico E, che può essere scritto utilizzando il corrispondente moltiplicatore esponenziale di Boltzmann:
![]()
Questa espressione implica la quantità kT con la dimensione dell'energia.
Il calcolo della probabilità viene utilizzato non solo per calcoli nella teoria cinetica dei gas ideali, ma anche in altri settori, ad esempio nella cinetica chimica nell'equazione di Arrhenius.
articolo principale: Entropia termodinamica
Entropia S di un sistema termodinamico isolato in equilibrio termodinamico è determinato attraverso il logaritmo naturale del numero di diversi microstati W, corrispondente ad un dato stato macroscopico (ad esempio, uno stato con una data energia totale E):
![]()
Fattore di proporzionalità Kè la costante di Boltzmann. Questa è un'espressione che definisce la relazione tra stati microscopici e macroscopici (via W ed entropia S rispettivamente), esprime l'idea centrale della meccanica statistica ed è la principale scoperta di Boltzmann.
La termodinamica classica utilizza l'espressione di Clausius per l'entropia:
![]()
Quindi, la comparsa della costante di Boltzmann K può essere visto come una conseguenza della connessione tra le definizioni termodinamiche e statistiche dell'entropia.
L'entropia può essere espressa in unità K, che dà quanto segue:
In tali unità, l'entropia corrisponde esattamente all'entropia dell'informazione.
Energia caratteristica kT pari alla quantità di calore necessaria per aumentare l’entropia S"per un nat.
A differenza di altre sostanze, nei semiconduttori esiste una forte dipendenza della conduttività elettrica dalla temperatura:
dove il fattore σ 0 dipende piuttosto debolmente dalla temperatura rispetto all'esponenziale, E A– energia di attivazione della conduzione. La densità degli elettroni di conduzione dipende anche in modo esponenziale dalla temperatura. Per la corrente che attraversa una giunzione p-n del semiconduttore, invece dell'energia di attivazione, considerare l'energia caratteristica di una data giunzione p-n alla temperatura T come energia caratteristica di un elettrone in un campo elettrico:
Dove Q- , UN V T c'è stress termico a seconda della temperatura.
Questa relazione è la base per esprimere la costante di Boltzmann in unità di eV∙K −1. A temperatura ambiente (≈ 300 K) il valore della tensione termica è di circa 25,85 millivolt ≈ 26 mV.
Nella teoria classica viene spesso utilizzata una formula secondo la quale la velocità effettiva dei portatori di carica in una sostanza è uguale al prodotto della mobilità dei portatori μ e dell'intensità del campo elettrico. Un'altra formula mette in relazione la densità del flusso portante con il coefficiente di diffusione D e con un gradiente di concentrazione del portatore N :
![]()
Secondo la relazione di Einstein-Smoluchowski, il coefficiente di diffusione è legato alla mobilità:
![]()
Costante di Boltzmann Kè compreso anche nella legge di Wiedemann-Franz, secondo la quale il rapporto tra il coefficiente di conducibilità termica e il coefficiente di conducibilità elettrica nei metalli è proporzionale alla temperatura e al quadrato del rapporto tra la costante di Boltzmann e la carica elettrica.
Per delimitare regioni di temperatura in cui il comportamento della materia è descritto con metodi quantistici o classici, viene utilizzata la temperatura di Debye:
![]()
Dove - , ![]() è la frequenza limite delle vibrazioni elastiche del reticolo cristallino, tu– velocità del suono in un corpo solido, N– concentrazione di atomi.
è la frequenza limite delle vibrazioni elastiche del reticolo cristallino, tu– velocità del suono in un corpo solido, N– concentrazione di atomi.
Costante di Boltzmann (k (\displaystyle k) O kB (\displaystyle k_(\rm (B)))) - una costante fisica che determina la relazione tra temperatura ed energia. Prende il nome dal fisico austriaco Ludwig Boltzmann, che diede importanti contributi alla fisica statistica, nella quale questa costante gioca un ruolo chiave. Il suo valore sperimentale nel Sistema Internazionale di Unità (SI) è:
k = 1.380 648 52 (79) × 10 − 23 (\displaystyle k=1(,)380\,648\,52(79)\times 10^(-23)) J/.I numeri tra parentesi indicano l'errore standard nelle ultime cifre del valore della quantità.
1 / 3
✪ Maxwell - Distribuzione di Boltzmann (parte 6) | Termodinamica | Fisica
✪ Lezione 433. Effetto foto. Leggi dell'effetto fotoelettrico
✪ Come trasformare il bianco in nero. Naturalmente!
In un gas ideale omogeneo a temperatura assoluta T (\displaystyle T), l'energia per ciascun grado di libertà traslazionale è uguale, come segue dalla distribuzione di Maxwell, k T / 2 (\displaystyle kT/2). A temperatura ambiente (300 ) questa energia è 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J, o 0,013 eV. In un gas ideale monoatomico, ogni atomo ha tre gradi di libertà corrispondenti a tre assi spaziali, il che significa che ogni atomo ha un'energia di 3 2 kT (\displaystyle (\frac (3)(2))kT).
Conoscendo l'energia termica, possiamo calcolare la velocità quadratica media degli atomi, che è inversamente proporzionale alla radice quadrata della massa atomica. La velocità quadratica media a temperatura ambiente varia da 1370 m/s per l'elio a 240 m/s per lo xeno. Nel caso di un gas molecolare la situazione diventa più complicata, ad esempio un gas biatomico ha cinque gradi di libertà (a basse temperature, quando le vibrazioni degli atomi nella molecola non sono eccitate).
L'entropia di un sistema termodinamico è definita come il logaritmo naturale del numero di diversi microstati Z (\displaystyle Z), corrispondente ad un dato stato macroscopico (ad esempio, uno stato con una data energia totale).
S = k ln Z . (\displaystyle S=k\ln Z.)Fattore di proporzionalità k (\displaystyle k) ed è la costante di Boltzmann. Questa è un'espressione che definisce la relazione tra microscopico ( Z (\displaystyle Z)) e stati macroscopici ( S (\displaystyle S)), esprime l'idea centrale della meccanica statistica.
La XXIV Conferenza Generale dei Pesi e delle Misure, tenutasi dal 17 al 21 ottobre 2011, ha adottato una risoluzione in cui, in particolare, si proponeva che la futura revisione del Sistema Internazionale di Unità fosse effettuata in modo tale da fissare il valore della costante di Boltzmann, dopodiché sarà considerata definita esattamente. Di conseguenza, verrà eseguito esatto uguaglianza K=1.380 6X⋅10 −23 J/K, dove X sta per una o più cifre significative, che verranno determinate ulteriormente in base alle raccomandazioni CODATA più accurate. Questa presunta fissazione è associata al desiderio di ridefinire l'unità di temperatura termodinamica kelvin, collegando il suo valore con il valore della costante di Boltzmann.
Prende il nome dal fisico austriaco Ludwig Boltzmann, che diede importanti contributi alla fisica statistica, nella quale questa costante gioca un ruolo chiave. Il suo valore sperimentale nel sistema SI è
J/.I numeri tra parentesi indicano l'errore standard nelle ultime cifre del valore della quantità. In linea di principio, la costante di Boltzmann può essere ottenuta dalla definizione di temperatura assoluta e di altre costanti fisiche. Tuttavia, allo stato attuale delle conoscenze, calcolare la costante di Boltzmann utilizzando i principi primi è troppo complesso e irrealizzabile. Nel sistema naturale delle unità di Planck, l'unità naturale di temperatura è data in modo che la costante di Boltzmann sia uguale all'unità.
In un gas ideale omogeneo a temperatura assoluta T, l'energia per ciascun grado di libertà traslazionale è uguale, come segue dalla distribuzione di Maxwell KT/2. A temperatura ambiente (300 ) questa energia è ![]() J, o 0,013 eV. In un gas ideale monoatomico ogni atomo ha tre gradi di libertà corrispondenti a tre assi spaziali, il che significa che ogni atomo ha un'energia pari a 3/2( KT)
.
J, o 0,013 eV. In un gas ideale monoatomico ogni atomo ha tre gradi di libertà corrispondenti a tre assi spaziali, il che significa che ogni atomo ha un'energia pari a 3/2( KT)
.
Conoscendo l'energia termica, possiamo calcolare la velocità quadratica media degli atomi, che è inversamente proporzionale alla radice quadrata della massa atomica. La velocità quadratica media a temperatura ambiente varia da 1370 m/s per l'elio a 240 m/s per lo xeno. Nel caso di un gas molecolare la situazione si complica, ad esempio un gas biatomico ha già circa cinque gradi di libertà.
L'entropia di un sistema termodinamico è definita come il logaritmo naturale del numero di diversi microstati Z, corrispondente ad un dato stato macroscopico (ad esempio, uno stato con una data energia totale).
S = K ln Z.Fattore di proporzionalità K ed è la costante di Boltzmann. Questa è un'espressione che definisce la relazione tra microscopico ( Z) e stati macroscopici ( S), esprime l'idea centrale della meccanica statistica.
Fondazione Wikimedia. 2010.
Costante fisica k, pari al rapporto tra la costante universale dei gas R e il numero di Avogadro NA: k = R/NA = 1.3807.10 23 J/K. Prende il nome da L. Boltzmann... Grande dizionario enciclopedico
Una delle costanti fisiche fondamentali; uguale al rapporto tra la costante dei gas R e la costante di Avogadro NA, indicata con k; prende il nome dall'austriaco fisico L. Boltzmann. Il bp è compreso in alcune delle relazioni più importanti della fisica: nell'equazione... ... Enciclopedia fisica
COSTANTE DI BOLZMANN- (k) fisico universale. costante pari al rapporto tra il gas universale (vedi) e la costante di Avogadro NA: k = R/Na = (1.380658 ± 000012)∙10 23 J/K ... Grande Enciclopedia del Politecnico
Costante fisica k, pari al rapporto tra la costante universale dei gas R e il numero di Avogadro NA: k = R/NA = 1.3807·10 23 J/K. Prende il nome da L. Boltzmann. * * * COSTANTE DI BOLTZMANN COSTANTE DI BOLTZMANN, costante fisica k, pari a... ... Dizionario enciclopedico
Fis. costante k, uguale al rapporto dell'universale. costante dei gas R al numero di Avogadro NA: k = R/NA = 1,3807 x 10 23 J/K. Prende il nome da L. Boltzmann... Scienze naturali. Dizionario enciclopedico
Una delle costanti fisiche di base (Vedi Costanti fisiche), pari al rapporto tra la costante universale dei gas R e il numero di Avogadro NA. (numero di molecole in 1 mole o 1 kmol di una sostanza): k = R/NA. Prende il nome da L. Boltzmann. B.p.... ... Grande Enciclopedia Sovietica