Theoretisches Material Endlich können Sie sich von einem Spezialisten beraten lassen
Bitte übergeben Sie dieses Manuskript dem Herausgeber – ein einleitendes Wort („Ich bitte Sie“); Bitte sag mir, wie mutig er ist! - ganz...
Boltzmann-Konstante (k (\displaystyle k) oder k B (\displaystyle k_(\rm (B)))) - eine physikalische Konstante, die das Verhältnis zwischen Temperatur und Energie definiert. Benannt nach dem österreichischen Physiker Ludwig Boltzmann, der wichtige Beiträge zur statistischen Physik geleistet hat, in der diese Konstante eine Schlüsselrolle spielt. Sein Wert im Internationalen Einheitensystem SI ist aufgrund von Änderungen in den Definitionen der grundlegenden SI-Einheiten genau gleich
k = 1,380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\times 10^(-23)) J/.In einem homogenen idealen Gas bei absoluter Temperatur T (\displaystyle T), die Energie pro translatorischem Freiheitsgrad ist gleich, wie aus der Maxwell-Verteilung folgt, k T / 2 (\displaystyle kT/2). Bei Raumtemperatur (300 °C) beträgt diese Energie 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J oder 0,013 eV. In einem einatomigen idealen Gas hat jedes Atom drei Freiheitsgrade, die drei Raumachsen entsprechen, was bedeutet, dass jedes Atom eine Energie von hat 3 2 k T (\displaystyle (\frac (3)(2))kT).
Wenn wir die thermische Energie kennen, können wir die quadratische Durchschnittsgeschwindigkeit der Atome berechnen, die umgekehrt proportional zur Quadratwurzel der Atommasse ist. Die quadratische Durchschnittsgeschwindigkeit bei Raumtemperatur variiert zwischen 1370 m/s für Helium und 240 m/s für Xenon. Im Fall eines molekularen Gases wird die Situation komplizierter, zum Beispiel hat ein zweiatomiges Gas 5 Freiheitsgrade – 3 translatorische und 2 rotatorische (bei niedrigen Temperaturen, wenn die Schwingungen der Atome im Molekül nicht angeregt werden und zusätzliche Freiheitsgrade vorhanden sind). Freiheit werden nicht hinzugefügt).
Die Entropie eines thermodynamischen Systems ist definiert als der natürliche Logarithmus der Anzahl verschiedener Mikrozustände Z (\displaystyle Z), entsprechend einem gegebenen makroskopischen Zustand (zum Beispiel einem Zustand mit einer gegebenen Gesamtenergie).
S = k ln Z . (\displaystyle S=k\ln Z.)Proportionalitätsfaktor k (\displaystyle k) und ist Boltzmanns Konstante. Dies ist ein Ausdruck, der die Beziehung zwischen mikroskopischen ( Z (\displaystyle Z)) und makroskopische Zustände ( S (\displaystyle S)), drückt die zentrale Idee der statistischen Mechanik aus.
Nach dem Stefan-Boltzmann-Gesetz ist die Dichte der integralen hemisphärischen Strahlung E 0 hängt nur von der Temperatur ab und variiert proportional zur vierten Potenz der absoluten Temperatur T:
Die Stefan-Boltzmann-Konstante σ 0 ist eine physikalische Konstante, die im Gesetz enthalten ist und die volumetrische Dichte der Gleichgewichtswärmestrahlung eines absolut schwarzen Körpers bestimmt:

Historisch gesehen wurde das Stefan-Boltzmann-Gesetz vor dem Planckschen Strahlungsgesetz formuliert, woraus es als Konsequenz folgt. Das Plancksche Gesetz legt die Abhängigkeit der spektralen Flussdichte der Strahlung fest E 0 von der Wellenlänge λ und der Temperatur T:

wobei λ – Wellenlänge, m; Mit=2,998 · 10 8 m/s – Lichtgeschwindigkeit im Vakuum; T– Körpertemperatur, K;
H= 6,625 ×10 -34 J×s – Plancksches Wirkungsquantum.
Physikalische Konstante k, gleich dem Verhältnis der universellen Gaskonstante R=8314J/(kg×K) zur Avogadro-Zahl N / A.=6,022× 10 26 1/(kg×mol):

Anzahl unterschiedlicher Systemkonfigurationen aus N Teilchen für eine gegebene Menge von Zahlen n i(Anzahl der Teilchen in ich-der Zustand, dem die Energie e i entspricht) ist proportional zum Wert:

Größe W Es gibt eine Reihe von Vertriebswegen N Teilchen nach Energieniveaus. Wenn Beziehung (6) wahr ist, wird davon ausgegangen, dass das ursprüngliche System der Boltzmann-Statistik gehorcht. Zahlensatz n i, bei der die Nummer W Maximum, kommt am häufigsten vor und entspricht der wahrscheinlichsten Verteilung.
Physikalische Kinetik– mikroskopische Theorie von Prozessen in statistischen Nichtgleichgewichtssystemen.
Die Beschreibung einer großen Anzahl von Partikeln kann mit probabilistischen Methoden erfolgreich durchgeführt werden. Für ein einatomiges Gas wird der Zustand einer Reihe von Molekülen durch ihre Koordinaten und die Werte der Geschwindigkeitsprojektionen auf den entsprechenden Koordinatenachsen bestimmt. Mathematisch wird dies durch die Verteilungsfunktion beschrieben, die die Wahrscheinlichkeit charakterisiert, mit der sich ein Teilchen in einem bestimmten Zustand befindet:

ist die erwartete Anzahl von Molekülen im Volumen d d, deren Koordinaten im Bereich von bis +d liegen und deren Geschwindigkeiten im Bereich von bis +d liegen.
Wenn die zeitlich gemittelte potentielle Energie der Wechselwirkung von Molekülen im Vergleich zu ihrer kinetischen Energie vernachlässigt werden kann, wird das Gas als ideal bezeichnet. Ein ideales Gas heißt Boltzmann-Gas, wenn das Verhältnis der Weglänge der Moleküle in diesem Gas zur charakteristischen Größe der Strömung ist L natürlich, d.h.

Weil die Weglänge ist umgekehrt proportional 2(n ist die numerische Dichte 1/m 3, d ist der Durchmesser des Moleküls, m).
Größe
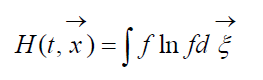
angerufen H-Boltzmann-Funktion für ein Einheitsvolumen, die mit der Wahrscheinlichkeit der Entdeckung eines Systems von Gasmolekülen in einem bestimmten Zustand verbunden ist. Jeder Zustand entspricht einer bestimmten Anzahl füllender sechsdimensionaler Raumgeschwindigkeitszellen, in die der Phasenraum der betrachteten Moleküle unterteilt werden kann. Bezeichnen wir W die Wahrscheinlichkeit, dass sich in der ersten Zelle des betrachteten Raums N 1 Moleküle befinden, in der zweiten N 2 usw.
Bis auf eine Konstante, die den Ursprung der Wahrscheinlichkeit bestimmt, gilt folgende Beziehung:
 ,
,
Wo  – H-Funktion eines Raumbereichs A mit Gas besetzt. Aus (9) geht hervor, dass W Und H miteinander verbunden, d.h. Eine Änderung der Wahrscheinlichkeit eines Zustands führt zu einer entsprechenden Entwicklung der H-Funktion.
– H-Funktion eines Raumbereichs A mit Gas besetzt. Aus (9) geht hervor, dass W Und H miteinander verbunden, d.h. Eine Änderung der Wahrscheinlichkeit eines Zustands führt zu einer entsprechenden Entwicklung der H-Funktion.

Das Boltzmannsche Prinzip stellt den Zusammenhang zwischen Entropie her S physikalisches System und thermodynamische Wahrscheinlichkeit W sie sagt:

(Veröffentlicht nach der Veröffentlichung: Kogan M.N. Dynamics of a rarefied gas. - M.: Nauka, 1967.)
Gesamtansicht des CUBE:

Wo ist die Massenkraft aufgrund der Anwesenheit verschiedener Felder (Gravitation, Elektrizität, Magnet), die auf das Molekül wirken? J– Kollisionsintegral. Es ist dieser Term der Boltzmann-Gleichung, der die Kollisionen von Molekülen untereinander und die entsprechenden Änderungen der Geschwindigkeiten wechselwirkender Teilchen berücksichtigt. Das Kollisionsintegral ist ein fünfdimensionales Integral und hat die folgende Struktur:

Gleichung (12) mit Integral (13) wurde für Stöße von Molekülen erhalten, bei denen keine Tangentialkräfte auftreten, d. h. kollidierende Teilchen gelten als vollkommen glatt.
Bei der Wechselwirkung ändert sich die innere Energie der Moleküle nicht, d.h. Es wird angenommen, dass diese Moleküle vollkommen elastisch sind. Wir betrachten zwei Gruppen von Molekülen, die Geschwindigkeiten und haben, bevor sie miteinander kollidieren (Kollision) (Abb. 1) und nach der Kollision Geschwindigkeiten und . Der Geschwindigkeitsunterschied wird Relativgeschwindigkeit genannt, d.h. . Es ist klar, dass für einen glatten elastischen Stoß . Verteilungsfunktionen f 1 ", f", f 1 , f beschreiben die Moleküle der entsprechenden Gruppen nach und vor Stößen, d. h. ; ![]() ;
; ![]() ;
; ![]() .
.

Reis. 1. Kollision zweier Moleküle.
(13) enthält zwei Parameter, die den Ort kollidierender Moleküle relativ zueinander charakterisieren: B und ε; B– Zielentfernung, d.h. der kleinste Abstand, auf den sich Moleküle ohne Wechselwirkung nähern würden (Abb. 2); ε wird als Kollisionswinkelparameter bezeichnet (Abb. 3). Integration vorbei B von 0 bis ¥ und von 0 bis 2p (zwei externe Integrale in (12)) deckt die gesamte Ebene der Kraftwechselwirkung senkrecht zum Vektor ab

Reis. 2. Die Flugbahn der Moleküle.

Reis. 3. Betrachtung der Wechselwirkung von Molekülen in einem Zylinderkoordinatensystem: z, B, ε
Die kinetische Boltzmann-Gleichung wird unter den folgenden Annahmen und Annahmen abgeleitet.
1. Es wird angenommen, dass es hauptsächlich zu Kollisionen zweier Moleküle kommt, d.h. Die Rolle von Kollisionen von drei oder mehr Molekülen gleichzeitig ist unbedeutend. Diese Annahme ermöglicht es uns, für die Analyse eine Einzelpartikel-Verteilungsfunktion zu verwenden, die oben einfach als Verteilungsfunktion bezeichnet wird. Die Berücksichtigung der Kollision dreier Moleküle führt dazu, dass in der Studie eine Zwei-Teilchen-Verteilungsfunktion verwendet werden muss. Dementsprechend wird die Analyse deutlich komplizierter.
2. Annahme eines molekularen Chaos. Dies drückt sich darin aus, dass die Wahrscheinlichkeiten, Teilchen 1 am Phasenpunkt und Teilchen 2 am Phasenpunkt zu erkennen, unabhängig voneinander sind.
3. Kollisionen von Molekülen mit beliebiger Auftreffentfernung sind gleich wahrscheinlich, d. h. Die Verteilungsfunktion ändert sich am Wechselwirkungsdurchmesser nicht. Dabei ist zu beachten, dass das analysierte Element klein sein muss F innerhalb dieses Elements ändert sich nicht, aber gleichzeitig ist die relative Schwankung ~ nicht groß. Die zur Berechnung des Kollisionsintegrals verwendeten Wechselwirkungspotentiale sind sphärisch symmetrisch, d. h. ![]() .
.
Der Gleichgewichtszustand des Gases wird durch die absolute Maxwellsche Verteilung beschrieben, die eine exakte Lösung der kinetischen Boltzmann-Gleichung ist:

Dabei ist m die Masse des Moleküls, kg.
Die allgemeine lokale Maxwellsche Verteilung, auch Maxwell-Boltzmann-Verteilung genannt:

für den Fall, dass sich das Gas als Ganzes mit Geschwindigkeit bewegt und die Variablen n, T von der Koordinate abhängen
und Zeit t.
Im Schwerefeld der Erde zeigt die exakte Lösung der Boltzmann-Gleichung:
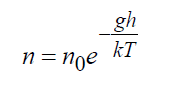
Wo N 0 = Dichte an der Erdoberfläche, 1/m3; G– Erdbeschleunigung, m/s 2 ; H– Höhe, m. Formel (16) ist eine exakte Lösung der kinetischen Boltzmann-Gleichung entweder im unbegrenzten Raum oder in Gegenwart von Grenzen, die diese Verteilung nicht verletzen, während die Temperatur ebenfalls konstant bleiben muss.
Diese Seite wurde von Puzina Yu.Yu gestaltet. mit Unterstützung der Russischen Stiftung für Grundlagenforschung – Projekt Nr. 08-08-00638.
Eine Konstante im Zusammenhang mit der Energie der Schwarzkörperstrahlung finden Sie unter Stefan-Boltzmann-Konstante
|
Konstanter Wert k |
Abmessungen |
|
1,380 6504(24) 10 −23 |
|
|
8,617 343(15) 10 −5 |
|
|
1,3807 10 −16 |
|
|
Siehe auch Werte in verschiedenen Einheiten weiter unten. |
|
Boltzmanns Konstante (k oder k B) ist eine physikalische Konstante, die den Zusammenhang zwischen der Temperatur eines Stoffes und der Energie der thermischen Bewegung von Teilchen dieses Stoffes bestimmt. Benannt nach dem österreichischen Physiker Ludwig Boltzmann, der wichtige Beiträge zur statistischen Physik geleistet hat, in der diese Konstante eine Schlüsselrolle spielt. Sein experimenteller Wert im SI-System beträgt
In der Tabelle geben die letzten Zahlen in Klammern den Standardfehler des konstanten Werts an. Im Prinzip lässt sich die Boltzmann-Konstante aus der Definition der absoluten Temperatur und anderer physikalischer Konstanten ermitteln. Die genaue Berechnung der Boltzmann-Konstante anhand erster Prinzipien ist jedoch zu komplex und mit dem aktuellen Wissensstand nicht durchführbar.
Die Boltzmannsche Konstante lässt sich experimentell mithilfe des Planckschen Gesetzes der Wärmestrahlung, das die Energieverteilung im Spektrum der Gleichgewichtsstrahlung bei einer bestimmten Temperatur des emittierenden Körpers beschreibt, sowie anderen Methoden bestimmen.
Es besteht ein Zusammenhang zwischen der universellen Gaskonstante und der Avogadro-Zahl, woraus sich der Wert der Boltzmann-Konstante ergibt:
Die Dimension der Boltzmann-Konstante ist dieselbe wie die der Entropie.
|
Im Jahr 1877 war Boltzmann der erste, der Entropie und Wahrscheinlichkeit verband, allerdings einen ziemlich genauen Wert der Konstante k als Kopplungskoeffizient in der Entropieformel tauchte nur in den Werken von M. Planck auf. Bei der Ableitung des Gesetzes der Schwarzkörperstrahlung, Planck in den Jahren 1900–1901. Für die Boltzmann-Konstante fand er einen Wert von 1,346 · 10 −23 J/K, fast 2,5 % weniger als der derzeit akzeptierte Wert.
Vor 1900 wurden die Beziehungen, die heute mit der Boltzmann-Konstante geschrieben werden, mit der Gaskonstante geschrieben R, und statt der durchschnittlichen Energie pro Molekül wurde die Gesamtenergie der Substanz verwendet. Lakonische Formel der Form S = k Protokoll W Auf der Büste von Boltzmann wurde es Planck zu verdanken. In seiner Nobelvorlesung 1920 schrieb Planck:
Diese Konstante wird oft als Boltzmann-Konstante bezeichnet, obwohl Boltzmann sie meines Wissens nie selbst eingeführt hat – ein seltsamer Zustand, obwohl Boltzmanns Aussagen nicht über die genaue Messung dieser Konstante sprachen.
Diese Situation kann durch die damals laufende wissenschaftliche Debatte zur Klärung des Wesens der atomaren Struktur der Materie erklärt werden. In der zweiten Hälfte des 19. Jahrhunderts gab es erhebliche Meinungsverschiedenheiten darüber, ob Atome und Moleküle real seien oder nur eine bequeme Möglichkeit, Phänomene zu beschreiben. Es bestand auch kein Konsens darüber, ob die durch ihre Atommasse unterschiedenen „chemischen Moleküle“ dieselben Moleküle waren wie in der kinetischen Theorie. Weiter findet sich in Plancks Nobelvorlesung folgendes:
„Nichts kann die positive und sich beschleunigende Geschwindigkeit des Fortschritts besser veranschaulichen als die Kunst des Experimentierens in den letzten zwanzig Jahren, in der viele Methoden gleichzeitig entdeckt wurden, um die Masse von Molekülen mit fast der gleichen Genauigkeit wie die Messung der Masse eines Planeten zu messen.“ ”
Für ein ideales Gas gilt das einheitliche Gasgesetz über den Druck P, Lautstärke V, Menge der Substanz N in Mol, Gaskonstante R und absolute Temperatur T:
In dieser Gleichheit können Sie eine Auswechslung vornehmen. Dann wird das Gasgesetz durch die Boltzmann-Konstante und die Anzahl der Moleküle ausgedrückt N im Gasvolumen V:
In einem homogenen idealen Gas bei absoluter Temperatur T, die Energie pro translatorischem Freiheitsgrad ist gleich, wie aus der Maxwell-Verteilung folgt, kT/ 2 . Bei Raumtemperatur (≈ 300 K) beträgt diese Energie ![]() J oder 0,013 eV.
J oder 0,013 eV.
In einem einatomigen idealen Gas hat jedes Atom drei Freiheitsgrade, entsprechend drei Raumachsen, was bedeutet, dass jedes Atom eine Energie von 3 hat kT/ 2 . Dies stimmt gut mit experimentellen Daten überein. Wenn wir die thermische Energie kennen, können wir die quadratische Durchschnittsgeschwindigkeit der Atome berechnen, die umgekehrt proportional zur Quadratwurzel der Atommasse ist. Die quadratische Durchschnittsgeschwindigkeit bei Raumtemperatur variiert zwischen 1370 m/s für Helium und 240 m/s für Xenon.
Die kinetische Theorie liefert eine Formel für den Durchschnittsdruck P ideales Gas:
![]()
Wenn man bedenkt, dass die durchschnittliche kinetische Energie einer geradlinigen Bewegung gleich ist:
![]()
Wir finden die Zustandsgleichung eines idealen Gases:
Diese Beziehung gilt auch für molekulare Gase; Allerdings ändert sich die Abhängigkeit der Wärmekapazität, da die Moleküle im Verhältnis zu den Freiheitsgraden, die mit der Bewegung der Moleküle im Raum verbunden sind, zusätzliche innere Freiheitsgrade haben können. Beispielsweise verfügt ein zweiatomiges Gas bereits über etwa fünf Freiheitsgrade.
Im Allgemeinen steht das System mit einem Wärmereservoir bei einer Temperatur im Gleichgewicht T hat eine Wahrscheinlichkeit P einen Energiezustand einnehmen E, was mit dem entsprechenden exponentiellen Boltzmann-Multiplikator geschrieben werden kann:
![]()
Dieser Ausdruck beinhaltet die Menge kT mit der Dimension der Energie.
Die Wahrscheinlichkeitsrechnung wird nicht nur für Berechnungen in der kinetischen Theorie idealer Gase verwendet, sondern auch in anderen Bereichen, beispielsweise in der chemischen Kinetik in der Arrhenius-Gleichung.
Hauptartikel: Thermodynamische Entropie
Entropie S eines isolierten thermodynamischen Systems im thermodynamischen Gleichgewicht wird durch den natürlichen Logarithmus der Anzahl verschiedener Mikrozustände bestimmt W, entsprechend einem gegebenen makroskopischen Zustand (zum Beispiel einem Zustand mit einer gegebenen Gesamtenergie). E):
![]()
Proportionalitätsfaktor k ist Boltzmanns Konstante. Dies ist ein Ausdruck, der die Beziehung zwischen mikroskopischen und makroskopischen Zuständen definiert (via W und Entropie S dementsprechend) drückt die zentrale Idee der statistischen Mechanik aus und ist die Hauptentdeckung von Boltzmann.
Die klassische Thermodynamik verwendet den Clausius-Ausdruck für die Entropie:
![]()
So entsteht die Boltzmann-Konstante k kann als Folge des Zusammenhangs zwischen thermodynamischen und statistischen Definitionen der Entropie angesehen werden.
Entropie kann in Einheiten ausgedrückt werden k, was Folgendes ergibt:
In solchen Einheiten entspricht die Entropie genau der Informationsentropie.
Charakteristische Energie kT gleich der Wärmemenge, die zur Erhöhung der Entropie erforderlich ist S„für ein Nat.
Im Gegensatz zu anderen Stoffen besteht bei Halbleitern eine starke Abhängigkeit der elektrischen Leitfähigkeit von der Temperatur:
wobei der Faktor σ 0 im Vergleich zum Exponential eher schwach von der Temperatur abhängt, E A– Leitungsaktivierungsenergie. Die Dichte der Leitungselektronen hängt auch exponentiell von der Temperatur ab. Berücksichtigen Sie für den Strom durch einen pn-Übergang eines Halbleiters anstelle der Aktivierungsenergie die charakteristische Energie eines bestimmten pn-Übergangs bei der Temperatur T als charakteristische Energie eines Elektrons in einem elektrischen Feld:
Wo Q- , A V T Je nach Temperatur kommt es zu thermischer Belastung.
Diese Beziehung ist die Grundlage für die Darstellung der Boltzmann-Konstante in Einheiten von eV∙K −1. Bei Raumtemperatur (≈ 300 K) beträgt der Thermospannungswert etwa 25,85 Millivolt ≈ 26 mV.
In der klassischen Theorie wird häufig eine Formel verwendet, nach der die effektive Geschwindigkeit von Ladungsträgern in einem Stoff gleich dem Produkt aus der Ladungsträgermobilität μ und der elektrischen Feldstärke ist. Eine andere Formel bezieht die Trägerflussdichte auf den Diffusionskoeffizienten D und mit einem Trägerkonzentrationsgradienten N :
![]()
Gemäß der Einstein-Smoluchowski-Beziehung hängt der Diffusionskoeffizient mit der Mobilität zusammen:
![]()
Boltzmanns Konstante k ist auch im Wiedemann-Franz-Gesetz enthalten, wonach das Verhältnis des Wärmeleitfähigkeitskoeffizienten zum elektrischen Leitfähigkeitskoeffizienten in Metallen proportional zur Temperatur und dem Quadrat des Verhältnisses der Boltzmann-Konstante zur elektrischen Ladung ist.
Um Temperaturbereiche abzugrenzen, in denen das Verhalten von Materie mit Quanten- oder klassischen Methoden beschrieben wird, wird die Debye-Temperatur verwendet:
![]()
Wo - , ![]() ist die Grenzfrequenz der elastischen Schwingungen des Kristallgitters, u– Schallgeschwindigkeit in einem Feststoff, N– Konzentration von Atomen.
ist die Grenzfrequenz der elastischen Schwingungen des Kristallgitters, u– Schallgeschwindigkeit in einem Feststoff, N– Konzentration von Atomen.
Boltzmann-Konstante (k (\displaystyle k) oder k B (\displaystyle k_(\rm (B)))) - eine physikalische Konstante, die das Verhältnis zwischen Temperatur und Energie bestimmt. Benannt nach dem österreichischen Physiker Ludwig Boltzmann, der wichtige Beiträge zur statistischen Physik geleistet hat, in der diese Konstante eine Schlüsselrolle spielt. Sein experimenteller Wert im Internationalen Einheitensystem (SI) beträgt:
k = 1,380 648 52 (79) × 10 − 23 (\displaystyle k=1(,)380\,648\,52(79)\times 10^(-23)) J/.Die Zahlen in Klammern geben den Standardfehler in den letzten Ziffern des Mengenwerts an.
1 / 3
✪ Maxwell-Boltzmann-Verteilung (Teil 6) | Thermodynamik | Physik
✪ Lektion 433. Fotoeffekt. Gesetze des photoelektrischen Effekts
✪ Wie man aus Weiß Schwarz macht. Natürlich!
In einem homogenen idealen Gas bei absoluter Temperatur T (\displaystyle T), die Energie pro translatorischem Freiheitsgrad ist gleich, wie aus der Maxwell-Verteilung folgt, k T / 2 (\displaystyle kT/2). Bei Raumtemperatur (300 °C) beträgt diese Energie 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21)) J oder 0,013 eV. In einem einatomigen idealen Gas hat jedes Atom drei Freiheitsgrade, die drei Raumachsen entsprechen, was bedeutet, dass jedes Atom eine Energie von hat 3 2 k T (\displaystyle (\frac (3)(2))kT).
Wenn wir die thermische Energie kennen, können wir die quadratische Durchschnittsgeschwindigkeit der Atome berechnen, die umgekehrt proportional zur Quadratwurzel der Atommasse ist. Die quadratische Durchschnittsgeschwindigkeit bei Raumtemperatur variiert zwischen 1370 m/s für Helium und 240 m/s für Xenon. Im Fall eines molekularen Gases wird die Situation komplizierter, zum Beispiel hat ein zweiatomiges Gas fünf Freiheitsgrade (bei niedrigen Temperaturen, wenn die Schwingungen der Atome im Molekül nicht angeregt werden).
Die Entropie eines thermodynamischen Systems ist definiert als der natürliche Logarithmus der Anzahl verschiedener Mikrozustände Z (\displaystyle Z), entsprechend einem gegebenen makroskopischen Zustand (zum Beispiel einem Zustand mit einer gegebenen Gesamtenergie).
S = k ln Z . (\displaystyle S=k\ln Z.)Proportionalitätsfaktor k (\displaystyle k) und ist Boltzmanns Konstante. Dies ist ein Ausdruck, der die Beziehung zwischen mikroskopischen ( Z (\displaystyle Z)) und makroskopische Zustände ( S (\displaystyle S)), drückt die zentrale Idee der statistischen Mechanik aus.
Die XXIV. Generalkonferenz für Maß und Gewicht, die vom 17. bis 21. Oktober 2011 stattfand, verabschiedete eine Resolution, in der insbesondere vorgeschlagen wurde, dass die künftige Überarbeitung des Internationalen Einheitensystems so durchgeführt werden sollte, dass Legen Sie den Wert der Boltzmann-Konstante fest, danach gilt er als definitiv genau. Als Ergebnis wird es ausgeführt genau Gleichwertigkeit k=1,380 6X⋅10 −23 J/K, wobei X für eine oder mehrere signifikante Zahlen steht, die anhand der genauesten CODATA-Empfehlungen weiter bestimmt werden. Diese angebliche Fixierung ist mit dem Wunsch verbunden, die Einheit der thermodynamischen Temperatur Kelvin neu zu definieren und ihren Wert mit dem Wert der Boltzmann-Konstante zu verbinden.
Benannt nach dem österreichischen Physiker Ludwig Boltzmann, der wichtige Beiträge zur statistischen Physik geleistet hat, in der diese Konstante eine Schlüsselrolle spielt. Sein experimenteller Wert im SI-System beträgt
J/.Die Zahlen in Klammern geben den Standardfehler in den letzten Ziffern des Mengenwerts an. Im Prinzip lässt sich die Boltzmann-Konstante aus der Definition der absoluten Temperatur und anderer physikalischer Konstanten ermitteln. Die Berechnung der Boltzmann-Konstante nach ersten Prinzipien ist jedoch zu komplex und mit dem aktuellen Wissensstand nicht durchführbar. Im natürlichen System der Planck-Einheiten ist die natürliche Einheit der Temperatur so gegeben, dass die Boltzmann-Konstante gleich eins ist.
In einem homogenen idealen Gas bei absoluter Temperatur T ist die Energie pro translatorischem Freiheitsgrad gleich, wie aus der Maxwell-Verteilung hervorgeht kT/ 2 . Bei Raumtemperatur (300 °C) beträgt diese Energie ![]() J oder 0,013 eV. In einem einatomigen idealen Gas hat jedes Atom drei Freiheitsgrade, die drei Raumachsen entsprechen, was bedeutet, dass jedes Atom eine Energie von 3/2( kT)
.
J oder 0,013 eV. In einem einatomigen idealen Gas hat jedes Atom drei Freiheitsgrade, die drei Raumachsen entsprechen, was bedeutet, dass jedes Atom eine Energie von 3/2( kT)
.
Wenn wir die thermische Energie kennen, können wir die quadratische Durchschnittsgeschwindigkeit der Atome berechnen, die umgekehrt proportional zur Quadratwurzel der Atommasse ist. Die quadratische Durchschnittsgeschwindigkeit bei Raumtemperatur variiert zwischen 1370 m/s für Helium und 240 m/s für Xenon. Bei einem molekularen Gas wird die Situation komplizierter, beispielsweise verfügt ein zweiatomiges Gas bereits über etwa fünf Freiheitsgrade.
Die Entropie eines thermodynamischen Systems ist definiert als der natürliche Logarithmus der Anzahl verschiedener Mikrozustände Z, entsprechend einem gegebenen makroskopischen Zustand (zum Beispiel einem Zustand mit einer gegebenen Gesamtenergie).
S = k ln Z.Proportionalitätsfaktor k und ist Boltzmanns Konstante. Dies ist ein Ausdruck, der die Beziehung zwischen mikroskopischen ( Z) und makroskopische Zustände ( S), drückt die zentrale Idee der statistischen Mechanik aus.
Wikimedia-Stiftung. 2010.
Physikalische Konstante k, gleich dem Verhältnis der universellen Gaskonstante R zur Avogadro-Zahl NA: k = R/NA = 1,3807,10 23 J/K. Benannt nach L. Boltzmann... Großes enzyklopädisches Wörterbuch
Eine der grundlegenden physikalischen Konstanten; gleich dem Verhältnis der Gaskonstante R zur Avogadro-Konstante NA, bezeichnet mit k; benannt nach dem Österreicher Physiker L. Boltzmann. Der bp geht in eine Reihe der wichtigsten Beziehungen der Physik ein: in die Gleichung... ... Physische Enzyklopädie
BOLZMANN KONSTANTE- (k) universelle physikalische. Konstante gleich dem Verhältnis des Universalgases (siehe) zur Avogadro-Konstante NA: k = R/Na = (1,380658 ± 000012)∙10 23 J/K ... Große Polytechnische Enzyklopädie
Physikalische Konstante k, gleich dem Verhältnis der universellen Gaskonstante R zur Avogadro-Zahl NA: k = R/NA = 1,3807·10 23 J/K. Benannt nach L. Boltzmann. * * * BOLTZMANNS KONSTANTE BOLTZMANNS KONSTANTE, physikalische Konstante k, gleich... ... Enzyklopädisches Wörterbuch
Physik. Konstante k, gleich dem Verhältnis des Universellen. Gaskonstante R zur Avogadro-Zahl NA: k = R/NA = 1,3807 x 10 23 J/K. Benannt nach L. Boltzmann... Naturgeschichte. Enzyklopädisches Wörterbuch
Eine der grundlegenden physikalischen Konstanten (siehe Physikalische Konstanten), gleich dem Verhältnis der universellen Gaskonstante R zur Avogadro-Zahl NA. (Anzahl der Moleküle in 1 Mol oder 1 kmol einer Substanz): k = R/NA. Benannt nach L. Boltzmann. B. p.... ... Große sowjetische Enzyklopädie